Structure d'oxyde de baryum (BAO), propriétés, utilisations, risques

- 1624
- 1
- Justine Charpentier
Il oxyde de baryum C'est un solide inorganique formé par un atome de baryum (BA) et un atome d'oxygène (O). Sa formule chimique est bao. C'est un solide cristallin blanc et est hygroscopique, c'est-à-dire qu'il absorbe l'humidité de l'air, mais ce faisant, il réagit avec cela.
La réaction rapide de l'oxyde de baryum avec l'eau le rend utilisé dans les laboratoires d'analyse chimique, c'est-à-dire l'élimination de l'eau des solvants organiques, qui sont des composés liquides qui servent à dissoudre d'autres substances.
 Oxyde de baryum Bao solide. Lem [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Oxyde de baryum Bao solide. Lem [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Bao se comporte comme une base forte, réagit donc avec de nombreux types d'acides. Par exemple, réagissez facilement avec le dioxyde de carbone2 de l'air pour former du carbonate de baryum Bacchus3.
Il sert dans la fabrication de polymères pour les câbles électriques et en tant qu'ingrédient de résines pour sceller les trous de dents qui ont été guéries.
L'oxyde de baryum (BAO) est également utilisé dans l'industrie de la céramique, à la fois pour le couvrir de vitrage et pour le fabriquer. Il est également utilisé dans les mélanges de ciment pour augmenter la résistance à la compression du produit final.
[TOC]
Structure
L'oxyde bao baar est formé par un cation ba2+ et un anion d'oxygène ou2-.
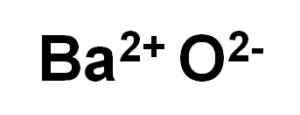 Ions oxyde de baryum bao. Auteur: Marilú Stea.
Ions oxyde de baryum bao. Auteur: Marilú Stea. Dans ses cristaux, le bao forme des réseaux ioniques cubes (sous la forme d'un cube) du type de chlorure de sodium.
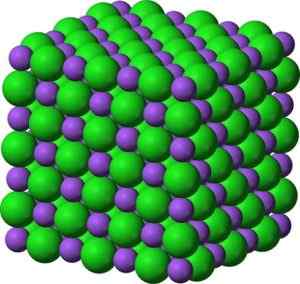 Structure cristalline en forme d'oxyde de baryum Bao similaire au chlorure de sodium. Vert: baryum. Bleu: oxygène. Benjah-Bmm27 (parler · contribs) [domaine public]. Source: Wikimedia Commons.
Structure cristalline en forme d'oxyde de baryum Bao similaire au chlorure de sodium. Vert: baryum. Bleu: oxygène. Benjah-Bmm27 (parler · contribs) [domaine public]. Source: Wikimedia Commons. La configuration électronique de l'ion baryum est: [xe] 6s0 Eh bien, les deux électrons de la couche 6s ont perdu. Cette configuration est très stable.
Nomenclature
-Oxyde de baryum
-Monoxyde de baryum
Il peut vous servir: Tester: caractéristiques, types, exemples d'utilisationsPropriétés physiques
État physique
Blanc jaunâtre solide cristallin.
Poids moléculaire
153,33 g / mol
Point de fusion
1923 ºC
Point d'ébullition
Environ 2000 ºC.
Densité
5,72 g / cm3
Solubilité
Petite eau soluble: 3,8 g / 100 ml à 20 ºC.
Propriétés chimiques
L'oxyde de bario bao réagit rapidement2, qui est l'hydroxyde le plus soluble entre les hydroxydes de métal alcalinetérique.
Bao + h2O → BA (OH)2
Bao est une base forte. Réagit exothermiquement (c'est-à-dire avec détachement de chaleur) avec tous les types d'acides.
Avec CO2 Bao réagit pour former le carbonate de baryum Bacchus3.
Bao + co2 → Bacchus3
Bao est hygroscopique, car s'il est autorisé à l'environnement, il est progressivement joint à l'humidité de l'air, formant BA (OH)2 qui est combiné avec du dioxyde de carbone2 de l'air pour donner du carbonate de baryum bacchus3.
Lorsque le monoxyde de baryum Bao est chauffé en présence d'air, il est combiné avec du bao de peroxyde de baryum formant l'oxygène2. La réaction est réversible.
2 bao + o2 ⇔ 2 bao2
En présence d'eau, il peut réagir avec l'aluminium à la OR avec FIFC Zn formant les oxydes ou les hydroxydes de ces métaux et générant de l'hydrogène gazeux H2.
Vous pouvez initier la polymérisation des composés organiques qui peuvent être polymérisés, comme les époxydes.
Des risques
Il peut être toxique par ingestion. Vous ne devez pas contacter la peau. Ce sont des yeux irritants, la peau et les voies respiratoires. Cela peut être nocif pour le système nerveux. Il est capable de provoquer de faibles niveaux de potassium, entraînant des troubles cardiaques et musculaires.
Obtention
L'oxyde de barium Bao peut être obtenu en chauffant le bario baco carbonate3 Avec du charbon. Bao est formé et le gaz monoxyde de carbone est libéré.
Bacchus3 + C → Bao + 2 Co ↑
Applications
Comme dessiccant des solvants organiques
En raison de sa facilité à réagir avec l'eau, Bao est utilisé depuis le milieu du siècle dernier comme dessiccant pour l'essence et les solvants organiques de base.
Il peut vous servir: acide cyanhydrique: structure moléculaire, propriétés, utilisationsLe bao est très actif qui sèche autour de lui, il prend l'humidité très rapidement, avec une évolution de la chaleur, formant un hydroxyde de baryum BA (OH)2 qui est stable jusqu'à environ 1000 ºC. Par conséquent, le bao peut être utilisé à des températures élevées.
Il a également une capacité d'absorption d'eau élevée. Pour chaque molécule Bao, on peut absorber une eau et le BA (OH)2 peut également absorber une certaine quantité d'eau.
Il convient aux laboratoires de chimie analytique. Ce n'est pas collant.
Il peut être utilisé dans les dessiccateurs, qui sont de grands récipients en verre avec un couvercle où l'atmosphère interne sèche est maintenue. Le bao maintient la miniatmosphère du dessiccateur à sec.
 Distinteurs dans un laboratoire. Le solide dessicant comme Bao est placé au bas de la base. Le téléchargeur d'origine était Rifleman 82 à English Wikipedia. [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons.
Distinteurs dans un laboratoire. Le solide dessicant comme Bao est placé au bas de la base. Le téléchargeur d'origine était Rifleman 82 à English Wikipedia. [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons. Ces dessiccateurs servent à placer des substances ou des réactifs et les empêchent ainsi d'absorber l'eau de l'environnement.
Il sert également à sécher les gaz de base tels que l'ammoniac NH3.
En téléchargement les lampes
Le bao est placé dans les électrodes des lampes de décharge en tant que matériau d'écriture d'électrons.
Les lampes à décharge sont formées par un tube en verre, un quartz ou un autre matériau approprié, contiennent un gaz inerte et dans la plupart des cas une vapeur métallique. La vapeur métallique peut être du sodium ou du mercure.
 Lampe au mercure. Dmitry g [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Lampe au mercure. Dmitry g [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. À l'intérieur du tube, le choc électrique se produit car il a une électrode positive et négative.
Bao est placé dans des électrodes de lampes. Les électrons émis entrent en collision avec les atomes de vapeur métallique et transmet de l'énergie.
Il peut vous servir: oxyde de cuprique (CUO)Lorsque vous passez un courant électrique à travers ce gaz ou à la vapeur, il y a un rayonnement léger ou ultraviolet visible (UV).
Dans la fabrication en céramique
Bao est utilisé dans les compositions de revêtement en céramique vitrées.
 FADAGE DE BUILDAGE EN DOUPE avec des céramiques vitrées. Penny Mayes / Façade vitrée. Source: Wikimedia Commons.
FADAGE DE BUILDAGE EN DOUPE avec des céramiques vitrées. Penny Mayes / Façade vitrée. Source: Wikimedia Commons. Cependant, il a également été testé comme additif dans la préparation de la HOB.
Bao améliore efficacement les caractéristiques mécaniques et la résistance chimique de ce type de céramique. Il a une forte influence sur les propriétés thermiques et la composition de la phase cristalline des matériaux obtenus.
Dans la préparation des mélanges de ciment
Bao a été testé comme un composant du ciment phosphoaluminé.
Ce type de ciment est utile dans les environnements marins, car il n'a pas la même tendance à hydrater que les autres types de ciment, il ne souffre donc pas de pores ou d'expansion.
Cependant, les ciments de phosphoalumination doivent être renforcés dans leurs performances mécaniques pour pouvoir résister aux courants marins et à des coups de morceaux de glace flottants présents dans l'océan.
L'ajout de bao au ciment de phosphoalumination modifie la structure minérale dudit matériau, améliore la structure des pores et augmente considérablement la force de compression de la pâte de ciment.
En d'autres termes, Bao améliore la résistance à la compression de ce type de ciment.
 Mélanger pour le béton. L'oxyde de baryum Bao est utile pour améliorer certaines propriétés de ciment. Thamizhpparithi maari [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Mélanger pour le béton. L'oxyde de baryum Bao est utile pour améliorer certaines propriétés de ciment. Thamizhpparithi maari [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Dans plusieurs applications
Il est utilisé comme ingrédient pour fournir une opacité dans les résines dentaires pour le remplissage des trous dans les dents, effectué par des dentistes.
Il est également utilisé comme agent de nucléation pour la préparation de polymères de fluorure de polyvinylidène qui sont utilisés pour isoler les câbles électriques.
Les références
- Partyka, J. et al. (2016). Effet de l'ajout de Bao sur le frittage des matériaux de verre-ceramique de SiO2-Au2SOIT3-N / A2D'ACCORD2Système O-CAO / MGO. J Therm Anal Calim (2016) 125: 1095. Lien récupéré.Springer.com.
- Zhang, P. et al. (2019). Effet du bao sur la structure minérale et le comportement d'hydratation du ciment phosphoaluminé. J Therm Anal Calim (2019) 136: 2319. Lien récupéré.Springer.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Oxyde de baryum. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Smith, N.POUR. (2003). Éclairage. Principe. Dans le livre de référence de l'ingénieur électricien (seizième édition). Récupéré de ScienceDirect.com.
- Ebnejjad, s. (2003). Fluoropolymère mousse. Pvdf moussant. Dans la fusion des fluoroplastiques processibles. Récupéré de ScienceDirect.com.
- Stand, h.S. et McIntyre, L.H. (1930). L'oxyde de baryum comme dessicant. Indiana. Engin. Chem. Anal. Élégant. 1930, 2, 1, 12-15. Récupéré des pubs.ACS.org.
- « Structure du cyanure de sodium (NACN), propriétés, risques, utilisations
- Les 15 meilleurs aliments pour augmenter les fesses (naturel) »

