Structure du cyanure de sodium (NACN), propriétés, risques, utilisations

- 4805
- 559
- Noa Da silva
Il Le cyanure de sodium C'est un sel inorganique formé par un na cation sodium+ et un cyanure anion CN-. Sa formule chimique est nacn. Également connu sous le nom de cyanure de sodium, c'est un solide cristallin blanc. Il est hygroscopique, c'est-à-dire qu'il absorbe l'eau de l'environnement, et ses cristaux sont cubes comme le chlorure de sodium NaCl.
Lors de la dissolution dans l'eau, il a tendance à former du cyanure d'hydrogène HCN. Ses solutions dissolvent facilement l'or et l'argent. Cette fonctionnalité le fait extraire de l'or et de l'argent de ses minéraux. Les solutions utilisées à cet effet sont recyclées, c'est-à-dire qu'elles sont réutilisées plusieurs fois.
 Cyanure de sodium de sodium. L26 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Cyanure de sodium de sodium. L26 [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Cependant, un cyanure parvient à échapper à certains étangs des déchets, ce qui représente un danger pour la faune et l'être humain, car le cyanure est très toxique et peut provoquer la mort.
Le NACN est utilisé dans l'industrie chimique comme intermédiaire pour préparer plusieurs types de composés, tels que les colorants, les produits chimiques pour l'agriculture et les médicaments ou les médicaments.
Le cyanure de sodium est un composé très dangereux car il peut provoquer la mort, il doit donc être manipulé avec une extrême prudence.
[TOC]
Structure
Le cyanure de sodium est formé par un ion Na + et un ion CN-.
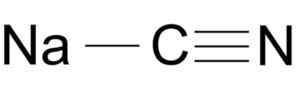 Structure de molécules de cyanure de sodium NACN. Arrowsmaster [Domaine public], Source: Wikimedia Commons.
Structure de molécules de cyanure de sodium NACN. Arrowsmaster [Domaine public], Source: Wikimedia Commons. L'ion cyanure a une voiture de voiture et une azote née par l'autre par un triple lien.
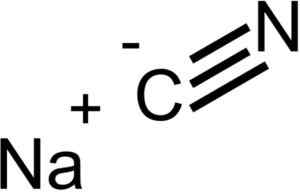 Ions qui composent le cyanure de sodium nacn. EPOP [domaine public]. Source: Wikimedia Commons.
Ions qui composent le cyanure de sodium nacn. EPOP [domaine public]. Source: Wikimedia Commons. NACN a la même structure cristalline que NaCl, donc ses cristaux sont cubes.
Nomenclature
-Le cyanure de sodium
-Le cyanure de sodium
Propriétés
État physique
Solide cristallin blanc hygroscopique (absorber l'eau de l'environnement).
Poids moléculaire
49 007 g / mol
Point de fusion
563,7 ºC
Point d'ébullition
1496 ºC
Point d'inflammation
Ce n'est pas inflammable. Mais s'il est exposé à un incendie, le cyanure d'hydrogène HCN et les oxydes d'azote se produisent.
Peut vous servir: sublimation: concept, processus et exemplesDensité
1 595 g / cm3 à 20 ºC
Solubilité
Très soluble dans l'eau: 48 g / 100 ml à 10 ° C, 82 g / 100 ml à 35 ° C. Légèrement soluble dans l'alcool
Constante de dissociation
Il est hydrolysé dans une solution aqueuse générant du cyanure d'hydrogène HCN. La constante de cette hydrolyse est kH = 2,5 x 10-5.
pH
Les solutions aqueuses NACN sont fortement alcalines
Propriétés chimiques
Lors de la dissolution dans l'eau, il se sépare dans ses ions nas+ et CN-. En solution aqueuse, le cyanure ion cn- Prendre un proton h+ d'eau h2Ou former du hcn et un oh ion-, Donc la solution devient alcaline.
CN- + H2O → HCN + OH-
Pour cette raison, leurs solutions aqueuses se décomposent rapidement en restant stockées, formant du cyanure d'hydrogène HCN.
Il est corrosif en aluminium. Ses solutions dissolvent facilement l'AU et Silver AG en présence d'air.
C'est un agent chélatant parce que l'anion cyanure CN- Il peut facilement rejoindre d'autres métaux, comme l'argent, l'or, le mercure, le zinc, le cadmium, etc.
Présente une faible odeur d'amandes amères.
Des risques
Doit être manipulé très soigneusement. Il s'agit d'un composé hautement toxique, inhibe les processus métaboliques importants et entraîne la mort à la fois pour l'ingestion, l'inhalation, l'absorption de la peau ou le contact visuel.
Si le NACN est inhalé, il se dissout dans la muqueuse des voies respiratoires et passe à la circulation sanguine. L'ion cyanure de NACN a une forte affinité pour le fer dans un état d'oxydation de +3, c'est-à-dire la foi de cation ferrique3+.
Lorsque le cyanure est absorbé, il réagit rapidement avec la foi3+ d'une enzyme importante des mitochondries des cellules (le cytochrome oxydase), empêchant certains processus de respiration.
Par conséquent, la respiration cellulaire est inhibée ou freine et est une hypoxie cytotoxique. Cela signifie que les cellules et les tissus sont incapables d'utiliser l'oxygène, en particulier les cellules du cerveau et cardiaque.
De cette façon, les dommages permanents ou mortels au corps se produisent. Cela peut arriver à la fois chez l'homme et les animaux.
Si la congestion des vaisseaux sanguins et la corrosion de la muqueuse gastrique ingère, en plus de ce qui a déjà été mentionné.
Peut vous servir: Justus von Liebig Le cyanure de sodium NACN peut provoquer la mort. Auteur: Openicons. Source: Pixabay.
Le cyanure de sodium NACN peut provoquer la mort. Auteur: Openicons. Source: Pixabay. Ce n'est pas du carburant, mais en contact avec les acides, il libère du HCN qui est très inflammable et toxique.
S'il fond avec des nitrites ou des chlorates, il peut exploiter.
Obtention
Il peut être obtenu avec du NA de sodium, l'ammoniac NH3 et charbon C. Le sodium réagit avec l'ammoniac donnant du sodium nanh2:
2 Na + 2 NH3 → 2 nanh2 + H2↑
L'amide de sodium est chauffé avec du carbone à 600 ºC et produit du cyanamide de sodium Na2NCN, qui avec du charbon à 800 ° C devient du cyanure de sodium:
2 nanh2 + C → 2 H2↑ + na2NCN
N / A2NCN + C → 2 NACN
Une autre méthode consiste à faire fondre le calcium et le cyanamide de charbon C avec du carbonate de sodium Na2CO3:
Cancn + c + na2CO3 → Caco3 + 2 NACN
Il peut également être préparé en passant à l'azote gazeux n2 pour un mélange chaud de carbonate de sodium2CO3 et le charbon C en poudre, en utilisant la foi de la foi comme catalyseur ou accélérateur de la réaction:
N / A2CO3 + 4 C + N2 → 2 NACN + 3 CO ↑
Applications
Dans l'extraction des minéraux d'or et d'argent. Conséquences
Le cyanure de sodium est utilisé depuis longtemps pour extraire les métaux d'or et d'argent de ses minéraux.
Le cyanure utilisé dans le processus est recyclé, mais quelque chose échappe à l'étang à déchets avec les métaux lourds non récupérés.
Les oiseaux, les chauves-souris et autres animaux qui boivent de ces lagunes avec du cyanure ont été empoisonnés.
Il y a des enregistrements d'un barrage de la Roumanie qui a gardé un étang à déchets isolé et a été endommagé par un événement météorologique.
En conséquence, des tonnes de cyanure ont été libérées sur la rivière Sasar et des systèmes aquifères à proximité tels que les rivières Lapus, Somes, Tisza, se terminant par le Danube.
Cela a provoqué une cascade de mort d'animaux, ou en d'autres termes, une catastrophe écologique.
 Extraction de l'or avec du cyanure en Nouvelle-Zélande vers 1918. Vous pouvez voir la quantité d'eau contaminée, qui a été libérée dans les rivières voisines. Bibliothèque nationale NZ sur les Communes [pas de restrictions]. Source: Wikimedia Commons.
Extraction de l'or avec du cyanure en Nouvelle-Zélande vers 1918. Vous pouvez voir la quantité d'eau contaminée, qui a été libérée dans les rivières voisines. Bibliothèque nationale NZ sur les Communes [pas de restrictions]. Source: Wikimedia Commons. Dans la production d'autres composés chimiques
Le cyanure de sodium NACN est utilisé dans la synthèse de divers types de composés organiques.
Peut vous servir: oxyde de sodium (NA2O): structure, formule, propriétés, risquesPar exemple, des pigments et des colorants sont préparés (y compris les vernis optiques), des composés à utiliser dans l'agriculture ou les agrochimiques et divers produits pharmaceutiques.
Il sert également à obtenir des agents chélateurs ou d'enlèvement d'ions métalliques.
Avec du cyanure de sodium, les composés appelés nitriles sont préparés, qui lorsqu'ils sont traités avec une solution aqueuse acide ou alcaline permet d'obtenir des acides carboxyliques.
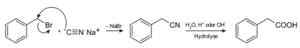 Préparation d'un acide carboxylique à l'aide de cyanure de sodium NACN. Roland Match [domaine public]. Source: Wikimedia Commons.
Préparation d'un acide carboxylique à l'aide de cyanure de sodium NACN. Roland Match [domaine public]. Source: Wikimedia Commons. Il permet de préparer les acides gras avec des groupes cyano, des cyanures de métaux lourds et un cyanure d'hydrogène HCN.
Dans l'industrie du métal
NACN est utilisé dans les solutions utilisées dans la galvanoplastie ou l'électrode métallique (revêtement métallique avec d'autres) par exemple le zinc.
C'est un composant de l'acier durci. Il sert également dans le nettoyage des métaux.
Dans d'autres utilisations
Le cyanure de sodium est un intermédiaire dans la fabrication de nylon.
Il est utilisé pour séparer les minéraux par flottation avec de la mousse.
Applications hors d'usage, interrogées ou très rares
La nation a été utilisée pour éliminer les rongeurs, comme les lapins et les rats et leurs terriers, et pour mettre fin aux nids de termites.
Il est actuellement utilisé de temps en temps pour éliminer les coyotes, les renards et les chiens sauvages. Il est utilisé sous forme de capsules comme des doses simples ou multiples dans les terres de pâturage, la chasse et les forêts.
En raison de son extrême toxicité, NACN ne doit être utilisé que par des personnes préparées.
Cette utilisation est considérée comme très dangereuse pour l'être humain, mais il y a ceux qui l'utilisent encore.
 La vie sauvage ne doit pas être éliminée, car ces animaux se battent déjà pour survivre dans des conditions difficiles. Auteur: MaxWDHS. Source: Pixabay.
La vie sauvage ne doit pas être éliminée, car ces animaux se battent déjà pour survivre dans des conditions difficiles. Auteur: MaxWDHS. Source: Pixabay. Dans l'agriculture, il était auparavant utilisé pour fumiger les agrumes et autres fruits. Il a également été utilisé comme un insecticide et un atténucide (éliminatrice des actes) après la récolte, pour les agrumes non mis. Il a également été utilisé pour fumiger les navires, les wagons et les entrepôts.
Toutes ces utilisations ont été remises en question par la toxicité élevée du cyanure de sodium. Pour cette raison, il n'est plus utilisé ou seulement très rarement et dans des conditions très contrôlées.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Le cyanure de sodium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Quatrième édition. John Wiley & Sons.
- Hurst, H.ET. et Martin, m.D. (2017). Toxicologie. Cyanure. En pharmacologie et thérapeutique pour la dentisterie (septième édition). Récupéré de ScienceDirect.com.
- Coppock, R.W. et dziwenka, m. (2015). Menaces contre la faune par des agents de guerre chimique. Dans Handbook of Toxicology of Chemical Warfare Agents (deuxième édition). Récupéré de ScienceDirect.com.
- Morrison, R.T. Et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.
- « Structure du trioxyde de soufre (SO3), propriétés, risques, utilisations
- Structure d'oxyde de baryum (BAO), propriétés, utilisations, risques »

