Modèle atomique de Rutherford History, expériences, postulats
- 1291
- 173
- Justine Charpentier
Il Modèle atomique de Rutherford C'est la description de l'atome créé par le physicien britannique Ernest Rutherford (1871-1937) alors qu'en 1911, il a découvert le noyau atomique, grâce aux célèbres expériences de dispersion nommées.
L'idée de l'atome ("indivisible«En grec) en tant que plus petite composante de la matière, c'était une création intellectuelle née dans la Grèce antique, environ 300 à.C. Comme tant d'autres concepts grecs, le concept de l'atome est développé sur la base de la logique et de l'argumentation, mais pas à l'expérimentation.
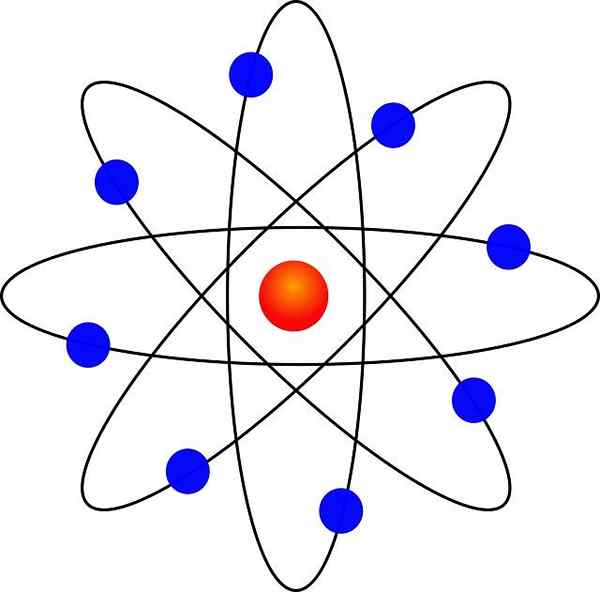
 Modèle atomique de Rutherford
Modèle atomique de Rutherford Les philosophes atomistes les plus notables étaient le démocrite d'Abdera (460 - 360 avant JC), Epicurus de Samos (341 - 270 AC) et Tito Lucrecio (98 - 54 AC). Les Grecs ont conçu quatre types d'atomes différents qui correspondaient aux quatre éléments qui, selon eux, ont formé la question: air, eau, terre et feu.
Par la suite, Aristote ajouterait un cinquième élément: l'éther qui formait les étoiles, car les quatre autres éléments étaient purement terrestres.
Les conquêtes d'Alexandre le Grand, dont Aristote était un enseignant, a élargi ses convictions pour le monde antique, de l'Espagne à l'Inde et, par conséquent, pendant des siècles, l'idée de atome Il a créé sa propre place dans le monde de la science.
[TOC]
L'atome cesse d'être indivisible
Les idées des philosophes grecs sur la structure du sujet ont été maintenues comme certains pendant des centaines d'années, jusqu'à ce qu'un chimiste et enseignant anglais appelle John Dalton (1776-1844) publie les résultats de ses expériences en 1808.
Dalton a convenu que les éléments sont constitués de particules extrêmement petites, appelées atomes. Mais cela est allé plus loin en déclarant que tous les atomes du même élément sont égaux, ils ont la même taille, la même masse et les mêmes propriétés chimiques, ce qui les rend inchangés lors d'une réaction chimique.
Ceci est le premier modèle atomique avec une fondation scientifique. Comme les Grecs, Dalton a continué à considérer l'atome comme indivisible, par conséquent, sans structure. Cependant, le génie de Dalton l'a amené à observer l'un des grands principes de la conservation de la physique:
- Dans les réactions chimiques, Les atomes ne sont ni créés ni détruits, Ils ne changent que leur distribution.
Et établi la manière dont les composés chimiques ont été formés par des «atomes de composés» (molécules):
- Lorsque deux atomes ou plus d'éléments différents sont combinés pour former le même composé, ils le font toujours dans des proportions en masse défini et constant.
Le XIXe siècle a été le grand siècle d'électricité et de magnétisme. Quelques années après les publications de Dalton, les résultats de certaines expériences ont semé des doutes parmi les scientifiques sur l'indivisibilité de l'atome.
Peut vous servir: quelle est la réactance capacitive et comment la calculer?Tube à escrocs
Le tube Crookes était un appareil conçu par le chimiste britannique et météorologue William Crookes (1832-1919). L'expérience que Crookes a réalisée en 1875, consistait à placer, à l'intérieur d'un tube plein de gaz à basse pression, deux électrodes, l'une appelée cathode Et un autre appelé anode.
En établissant une différence de potentiel entre les deux électrodes, le gaz a brillé avec une couleur caractéristique du gaz utilisé. Ce fait a suggéré qu'il y avait une certaine organisation particulière au sein de l'atome et que, par conséquent, il n'était pas indivisible.
De plus, ce rayonnement a produit une faible fluorescence dans la paroi du tube de verre devant la cathode, coupant l'ombre d'une marque en forme de croix située à l'intérieur du tube.
C'était un rayonnement mystérieux appelé "rayons de cathode", qui se déployait en ligne droite jusqu'à l'anode et qui était très énergique, capable de produire des effets mécaniques, et qui s'est dévié vers une plaque chargée positivement ou également par des aimants.
La découverte de l'électron
Le rayonnement à l'intérieur du tube Crookes n'a pas pu être traité, car il avait une charge négative. Joseph John Thomson (1856 - 1940) a trouvé la réponse en 1887 lorsqu'il a trouvé la relation entre la charge et la masse de ce rayonnement, et a constaté qu'il était toujours le même: 1,76 x 10onze C / kg., Quel que soit le gaz verrouillé dans le tube ou le matériau utilisé pour fabriquer la cathode.
Thomson a appelé ces particules corpuscules. En mesurant sa masse par rapport à sa charge électrique, il a conclu que chaque corpuscle était beaucoup plus petit qu'un atome. Par conséquent, il a suggéré qu'ils devraient en faire partie, découvrant ainsi le électron.
Le scientifique britannique a été le premier à décrire un modèle graphique de l'atome, à travers le dessin d'une sphère avec des points insérés qui, par sa forme, ont été donnés de l'appellation de "Buddin of Ciruela". Mais cette découverte a posé d'autres questions:
- Si la question est neutre et que l'électron a une charge négative: dans laquelle une partie de l'atome est la charge positive qui neutralise les électrons?
- Si la masse électronique est inférieure à celle de l'atome, alors que consiste le reste de l'atome?
- Pourquoi les particules ont-elles été obtenues toujours des électrons et jamais d'un autre type?
Expériences de dispersion de Rutherford: le noyau atomique et le proton
En 1898, Rutherford avait identifié deux types de rayonnement de l'uranium, qu'il a appelé alpha et bêta.
La radioactivité naturelle avait déjà été découverte par Marie Curie en 1896. Les particules alpha ont une charge positive et sont simplement des noyaux d'hélium, mais à ce moment-là, le concept de noyau n'était pas encore connu. Rutherford était sur le point de le découvrir.
Peut vous servir: Système thermodynamique: propriétés, types, exemplesL'une des expériences que Rutherford a réalisées en 1911 à l'Université de Manchester, avec l'aide de Hans Geiger, consistait à bombarder une feuille d'or fine avec des particules alpha, dont la charge est positive. Autour de la feuille d'or a placé un écran fluorescent qui leur a permis de visualiser les effets du bombardement.
Observations
L'étude des impacts sur l'écran fluorescent, Rutherford et ses assistants ont observé que:
- Un pourcentage élevé de particules alpha a traversé la feuille sans déviation notable.
- Certains déviés à des angles assez prononcés
- Et très peu rebondissant en arrière
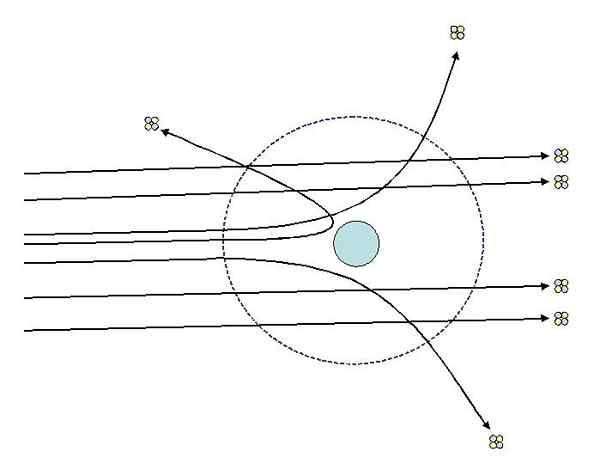 Expériences de dispersion de Rutherford. Source: [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]].
Expériences de dispersion de Rutherford. Source: [CC BY-SA 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Les observations 2 et 3 ont surpris les enquêteurs et les ont amenés à supposer que la personne responsable des rayons dispersés devrait avoir une charge positive et qu'en vertu de l'observation numéro 1, cette personne en charge avait une taille beaucoup plus petite que celle des particules alpha.
Rutherford lui-même a déclaré à cet égard que c'était "... comme si vous essayiez un projectile naval de 15 pouces contre une feuille de papier et que le projectile a rebondi et vous a frappé". Cela pourrait certainement être expliqué par le modèle Thompson.
Analysant ses résultats du point de vue classique, Rutherford avait découvert l'existence du noyau atomique, où le fardeau positif de l'atome qui a donné cette neutralité était concentré.
Rutherford a poursuivi ses expériences de dispersion. En 1918, la nouvelle cible des particules alpha était les atomes de l'azote gazeux.
De cette façon, il a détecté des noyaux d'hydrogène et a immédiatement su que le seul site à partir duquel ces noyaux pouvaient provenir de l'azote lui-même. Comment était-il possible que les noyaux d'hydrogène faisaient partie de l'azote?
Rutherford a ensuite suggéré que le noyau d'hydrogène, un élément qui avait déjà été attribué à l'atomique numéro 1, devrait être une particule fondamentale. Je l'appelle proton, Mot grec à désigner premier. Ainsi, les découvertes du noyau atomique et du proton sont dues à ce brillant néozyre.
Postule le modèle atomique de Rutherford
Le nouveau modèle était très différent de Thompson. Ce sont ses postulats:
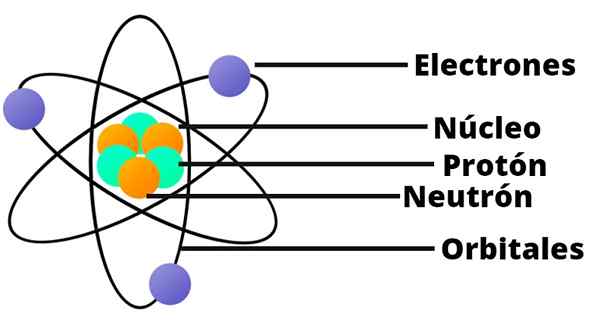
- L'atome contient un noyau chargé positivement qui, bien qu'il soit très petit, contient presque toute la masse de l'atome.
- Les électrons orbitent le noyau atomique à une grande distance et dans des orbites circulaires ou elliptiques.
- La charge nette de l'atome est vide, car les charges des électrons compensent la charge positive présente dans le noyau.
Les calculs de Rutherford indiquaient un noyau sphérique et une radio aussi petite que 10-quinze m, étant la valeur du rayon atomique environ 100.000 fois plus élevé, car les noyaux sont relativement très éloignés les uns des autres: de l'ordre de 10-dix m.
 Le jeune Ernest Rutherford. Source: Inconnu, publié en 1939 à Rutherford: être la vie et les lettres du RT. Son. Lord Rutherford, ou. M [cc par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]
Le jeune Ernest Rutherford. Source: Inconnu, publié en 1939 à Rutherford: être la vie et les lettres du RT. Son. Lord Rutherford, ou. M [cc par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] Cela explique pourquoi la plupart des particules alpha ont traversé la feuille sans inconvénient ou ont à peine connu une très petite déviation.
Vu dans les objets de tous les jours, l'atome de Rutherford serait composé d'un noyau de la taille d'un baseball, tandis que le rayon atomique serait d'environ 8 km. Par conséquent, l'atome peut être considéré comme presque tout comme un espace vide.
Grâce à sa similitude avec un système solaire miniature, il était connu sous le nom de "modèle planétaire de l'atome". La force d'attraction électrostatique entre le noyau et les électrons serait analogue à l'attraction gravitationnelle entre le soleil et les planètes.
Limites
Cependant, il y a eu certains désaccords concernant certains faits observés:
- Si l'idée que l'orbite électronique autour du noyau est acceptée, il arrive que l'électron devrait continuellement émettre un rayonnement jusqu'à ce qu'il entre en collision avec le noyau, avec la destruction conséquente de l'atome en beaucoup moins d'une seconde. Ceci, heureusement, ce n'est pas ce qui se passe vraiment.
- De plus, à certaines occasions, l'atome émet certaines fréquences de rayonnement électromagnétique lorsqu'il y a des transitions entre un état de plus grande énergie à un avec moins d'énergie, et seulement ces fréquences, pas d'autres. Comment expliquer le fait que l'énergie est quantifiée?
Malgré ces limites et qu'aujourd'hui, il existe des modèles beaucoup plus sophistiqués et selon les faits observés, le modèle atomique de Rutherford est toujours utile pour que l'étudiant ait une première approche réussie de l'atome et de ses particules constituantes.
Dans ce modèle de l'atome, le neutron n'apparaît pas, un autre constituant du noyau, qui n'a été découvert qu'en 1932.
Peu de temps après que Rutherford a proposé son modèle planétaire, en 1913, le physicien danois Niels Bohr le modifierait pour expliquer pourquoi l'atome n'est pas détruit et nous sommes toujours là pour raconter cette histoire.
Articles d'intérêt
Modèle atomique Schrödinger.
Modèle atomique broglie.
Modèle atomique de Chadwick.
Modèle atomique Heisenberg.
Modèle atomique perrin.
Modèle atomique Thomson.
Modèle atomique de Dirac Jordan.
Modèle atomique démocrite.
Modèle atomique bohr.
Modèle atomique de Dalton.
Les références
- Rex, un. 2011. Fondamentaux de la physique. Pearson. 618-621.
- Zapata, f. 2007. Notes de classe pour la chaise de radiobiologie et de protection radiologique. École de santé publique de l'Université centrale du Venezuela.
- « Caractéristiques des liens ioniques, comment formes et exemples
- Qu'est-ce qu'un rapporteur et comment faire un? »

