Caractéristiques des liens ioniques, comment formes et exemples

- 2265
- 155
- Anaïs Julien
Il lien ionique C'est un type de liaison chimique dans laquelle il y a une attraction électrostatique entre les ions avec une charge opposée. C'est-à-dire qu'un ion chargé positivement forme un lien avec un ion chargé négativement, transférant des électrons d'un atome à un autre.
Ce type de liaison chimique se produit lorsque les électrons de valence d'un atome sont transférés en permanence à un autre. L'atome qui perd les électrons devient un cation (chargé positivement), et celui qui gagne des électrons devient un anion (chargé négativement).
 Exemple de liaison ionique: fluorure de sodium. Le sodium perd un électron de valence et le donne au fluorure. Wdcf [cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Exemple de liaison ionique: fluorure de sodium. Le sodium perd un électron de valence et le donne au fluorure. Wdcf [cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)] [TOC]
Concept de lien ionique
La liaison ionique est celle par laquelle les particules chargées électriquement, appelées ions, interagissent pour donner naissance à des solides ioniques et des liquides. Ce lien est le produit d'interactions électrostatiques entre des centaines de millions d'ions, et n'est pas limité uniquement à quelques-unes; Autrement dit, cela va au-delà de l'attraction entre un fardeau positif vers une charge négative.
Considérez par exemple le composé ionique du chlorure de sodium, NaCl, connu mieux sous le nom de sel de table. Dans le NaCl, la liaison ionique prédominait, il est donc composé d'ions na+ et cl-. Puis un+ C'est l'ion ou le cation positif, tandis que le Cl- (Chlorure) est l'ion ou l'anion négatif.
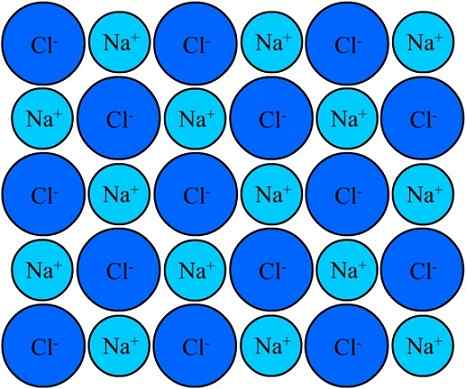 Les ions Na + et Cl- dans le chlorure de sodium restent unis grâce à la liaison ionique. Source: Eyal Bairey via Wikipedia.
Les ions Na + et Cl- dans le chlorure de sodium restent unis grâce à la liaison ionique. Source: Eyal Bairey via Wikipedia. Les deux+ Comme le CL- Ils sont attirés par des charges électriques opposées. Les distances entre ces ions permettent aux autres de s'approcher, de sorte que les paires et les paires NaCl apparaissent. Na cations+ Ils se repousseront les uns avec les autres pour être de charges égales, et la même chose se produit les unes avec les autres avec les anions CL-.
Il arrive un moment où des millions de na ions+ et cl- Ils parviennent à unifier, cohésifs, à créer une structure aussi stable que possible; A régi par le lien ionique (image supérieure). Na cations+ Ils sont plus petits que les anions CL- En raison de la force nucléaire efficace de croissance de son noyau sur les électrons externes.
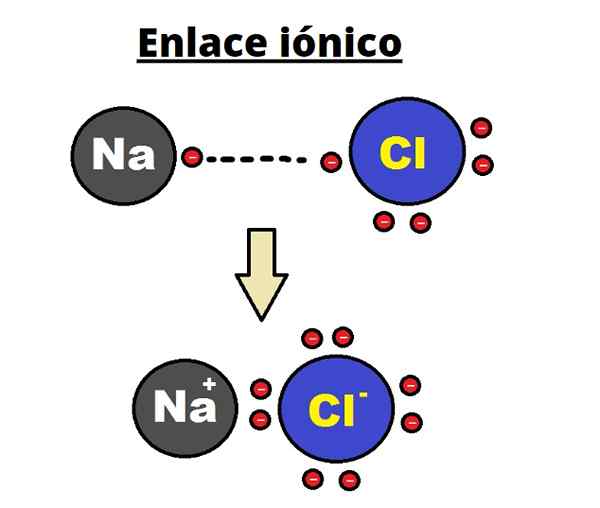 Lien naCl ionique. Rhannosh / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Lien naCl ionique. Rhannosh / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) La liaison ionique est caractérisée par l'établissement de structures ordonnées où la distance entre les ions (na+ et cl- Dans le cas de NaCl), il est petit par rapport à celui des autres solides. On parle d'une structure cristalline ionique.
Comment est un lien ionique?
La liaison ionique n'a lieu que si une distribution d'électrons se produit pour que les charges ioniques surgissent. Ce type de lien ne peut jamais se produire entre les particules neutres. Il doit nécessairement y avoir des cations et des anions. Mais d'où viennent-ils?
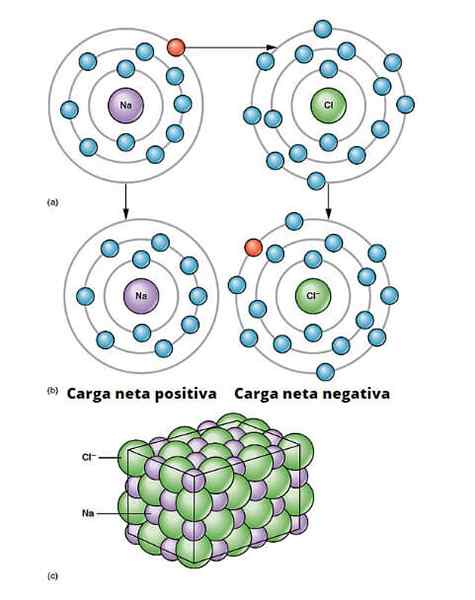 Illustration de lien ionique. a) Le sodium a une charge nette négative. b) Le sodium donne un électron au chlore. Le sodium est avec une charge nette positive et le chlore avec une charge nette négative, générant la liaison ionique. Ce type de lien entre des millions d'atomes Na et Cl donne naissance au sel physique. OpenX College / CC par (https: // CreenIvecommons.Org / licences / par / 3.0)
Illustration de lien ionique. a) Le sodium a une charge nette négative. b) Le sodium donne un électron au chlore. Le sodium est avec une charge nette positive et le chlore avec une charge nette négative, générant la liaison ionique. Ce type de lien entre des millions d'atomes Na et Cl donne naissance au sel physique. OpenX College / CC par (https: // CreenIvecommons.Org / licences / par / 3.0) Il existe de nombreuses façons dont les ions proviennent, mais en substance, beaucoup sont basés sur une réaction d'oxydation-réduction. La plupart des composés ioniques inorganiques sont constitués d'un élément métallique avec un élément non métallique (ceux du bloc p du tableau périodique).
Le métal doit oxyder, perdre des électrons, pour se transformer en cation. D'un autre côté, l'élément non métallique est réduit, gagne ces électrons et devient un anion. L'image suivante illustre ce point pour la formation de NaCl à partir des atomes de sodium et de chlore:
Peut vous servir: acide d'arsenic (H3SO4): propriétés, risques et utilisations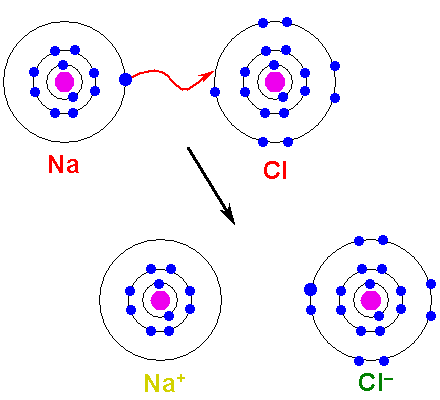 Formation d'un lien ionique. Source: Shafei à l'arabe wikipedia / domaine public
Formation d'un lien ionique. Source: Shafei à l'arabe wikipedia / domaine public L'atome de Na fait don de l'un de ses électrons Valencia au CL. Lorsque cette distribution d'électrons se produit, des ions na sont formés+ et cl-, qui commence à attirer immédiatement et électrostatiquement.
On dit donc que na+ et cl- Ils ne partagent aucune paire d'électrons, contrairement à ce que l'on pourrait s'attendre à une liaison covalente Na-Cl hypothétique.
Propriétés des liens ioniques
La liaison ionique est non directionnelle, c'est-à-dire que sa force n'est pas présente dans une seule direction, mais se propage par l'espace en fonction des distances qui séparent les ions. Ce fait est important, car cela signifie que les ions sont fortement unis, ce qui explique plusieurs des propriétés physiques des solides ioniques.
Point de fusion
La liaison ionique est responsable du sel à une température de 801 ºC. Cette température est considérablement élevée par rapport aux points de fusion de plusieurs métaux.
En effet, NaCl doit absorber suffisamment de chaleur pour que ses ions commencent à couler librement en dehors de leurs cristaux; c'est-à-dire que les attractions entre NA doivent être surmontées+ et cl-.
Point d'ébullition
Les points de fusion et d'ébullition des composés ioniques sont particulièrement élevés de leurs fortes interactions électrostatiques: leur liaison ionique. Cependant, comme ce lien implique de nombreux ions, ce comportement est généralement attribué aux forces intermoléculaires, et non correctement au lien ionique.
Dans le cas du sel, une fois le NaCl fondu, un liquide composé des mêmes ions initiaux est obtenu; Ce n'est que maintenant qu'ils bougent avec une plus grande liberté. Le lien ionique est toujours présent. Na ions+ et cl- Ils se rencontrent à la surface du liquide pour créer une grande tension de surface, ce qui empêche les ions de s'échapper de la phase gazeuse.
Par conséquent, le sel fondu doit encore augmenter sa température à ébullition. Le point d'ébullition de NaCl est de 1465 ºC. À cette température, la chaleur dépasse les attractions entre NA+ et cl- Dans le liquide, les vapeurs NaCl commencent donc à se former avec une pression égale à l'atmosphère.
Électronégativité
Auparavant, il a été dit que la liaison ionique se forme entre un élément métallique et un élément non métallique. En résumé des comptes: entre un métal et un non-métal. Habituellement, cela est en termes de composés ioniques inorganiques; Surtout, ceux de type binaire, comme NaCl.
Pour la distribution d'électrons (NA+CL-) Et pas un partage (Na-Cl), il doit y avoir une grande différence d'électronégativité entre les deux atomes. Sinon, il n'y aurait pas de lien ionique entre eux deux. Peut-être l'approche Na et Cl, interagir, mais immédiatement le CL, pour sa plus grande électronégativité, "arrache" un électron au na.
Cependant, ce scénario ne s'applique que pour les composés binaires, MX, tels que NaCl. Pour les autres sels ou composés ioniques, leurs processus de formation sont plus compliqués et ne peuvent pas être abordés d'un simple point de vue atomique ou moléculaire.
Il peut vous servir: AlquinosGars
Il n'y a pas de types différents de liaisons ioniques, car le phénomène électrostatique est purement physique, ne variant que la manière dont les ions interagissent ou le nombre d'atomes qu'ils possèdent; c'est-à-dire s'ils sont des ions monoatomiques ou polyiatomiques. De plus, chaque élément ou composé provoque un ion caractéristique qui définit la nature du composé.
Dans la section des exemples, ce point sera approfondi, et on verra que le lien ionique est le même en substance dans tous les composés. Lorsque cela n'est pas rempli, il est dit que le lien ionique a un certain caractère covalent, qui est le cas de nombreux métaux de transition, où les anions sont coordonnés avec les cations; Par exemple, FECL3 (Foi3+-CL-).
Exemples de liens ioniques
Plusieurs composés ioniques seront répertoriés ci-dessous, et leurs ions et proportions seront mis en évidence:
- Chlorure de magnésium
MGCL2, (Mg2+CL-), Dans une proportion 1: 2 (mg2+: 2 CL-)
- Fluorure de potassium
Kf, (k+F-), Dans une proportion 1: 1 (k+: F-)
- Sulfure de sodium
N / A2S, (na+S2-), Dans une proportion 2: 1 (2e+: S2-)
- Hydroxyde de lito
Lioh, (li+Oh-), Dans une proportion 1: 1 (li+: Oh-)
- Fluorure de calcium
Caf2, (AC2+F-), Dans une proportion 1: 2 (CA2+: 2F-)
- Carbonate de sodium
N / A2CO3, (N / A+CO32-), Dans une proportion 2: 1 (2e+: CO32-)
- Carbonate de calcium
Voleur3, (AC2+CO32-), Dans une proportion 1: 1 (CA2+: CO32-)
- Le permanganate de potassium
Kmno4, (K+Mne4-), Dans une proportion 1: 1 (k+: MN4-)
- Sulfate de cuivre
Cuso4, (Cu2+Swin42-), Dans une proportion 1: 1 (Cu2+: DONC42-)
- Hydroxyde de baryum
Ba (oh)2, (Ba2+Oh-), Dans une proportion 1: 2 (ba2+: Oh-)
- Bromure d'aluminium
Album3, (Au3+BR-), dans une proportion 1: 3 (à3+: 3BR-)
- Oxyde de fer (III)
Foi2SOIT3, (Foi3+SOIT2-), Dans une proportion 2: 3 (2fe3+: 32-)
- Oxyde de strontium
SRO, (SR2+SOIT2-), Dans une proportion 1: 1 (SR2+: SOIT2-)
- Chlorure d'argent
Agcl, (AG+CL-), Dans une proportion 1: 1 (AG+: CL-)
- Autres
-Ch3Cona, (choisissez3Roucouler-N / A+), Dans une proportion 1: 1 (CHO3Roucouler-: N / A+)
- NH4I, (NH4+Toi-), Dans une proportion 1: 1 (NH4+: Yo-)
Chacun de ces composés présente une liaison ionique où des millions d'ions, correspondant à leurs formules chimiques, sont attirés électrostatiquement et proviennent d'un solide. Plus l'ampleur de ses charges ioniques est grande, plus les attractions et les répulsions électrostatiques seront intenses.
Par conséquent, une obligation ionique a tendance à être plus forte, plus les charges des ions qui composent le composé.
Peut vous servir: alcènesExercices résolus
Certains exercices qui mettent les connaissances de base du lien ionique seront résolus ci-dessous.
- Exercice 1
Lequel des composés suivants est ionique? Les options sont: hf, h2Ou, non, h2S, NH3 et mgo.
Un composé ionique doit avoir un lien ionique par définition. Plus la différence d'électronégativité parmi ses éléments de composante est grande, plus le caractère ionique dudit lien est grand.
Par conséquent, les options qui n'ont pas d'élément métallique sont rejetées en principe: hf, h2Ou, h2S et NH3. Tous ces composés ne sont formés que par des éléments non métalliques. Le cation nh4+ C'est une exception à cette règle, car elle n'a pas de métal.
Les options restantes sont NAH et MGO, qui ont respectivement des métaux NA et MG, unis aux éléments non métalliques. Nah (na+H-) et mgo (mg2+SOIT2-) Ce sont des composés ioniques.
- Exercice 2
Considérez le composé hypothétique suivant: AG (NH4)2CO3Toi. Quels sont vos ions et dans quelle proportion est dans le solide?
Décomposer le composé sur leurs ions que nous avons: AG+, NH4+, CO32- et moi-. Ceux-ci sont rejoints en suivant la proportion 1: 2: 1: 1 (AG+: 2NH4+: CO32-: Yo-). Signifie que la quantité de cations nh4+ C'est le double que pour les ions agricoles+, CO32- et moi-.
- Exercice 3
Lequel des composés suivants serait attendu en principe que le lien ionique le plus fort avait? Les options sont: KBR, CAS, NA2Swin4, Cuo, Alpo4 et PB3P4.
Le KBR est composé de K ions+ et br-, Avec une amplitude de charge. Ensuite, Cas a les ions CA2+ et s2-, Avec des charges à double magnitude, on pourrait donc penser que la liaison ionique en CAS est plus forte que dans KBR; Et aussi plus fort que en na2Swin4, Comme ce dernier est composé de na ions+ Et ainsi42-.
CAS et CUO peuvent avoir une liaison ionique forte égale, car les deux contiennent des ions avec des charges à double magnitude. Ensuite, nous avons Alpo4, avec des ions al3+ et po43-. Ces ions ont des charges à triple ampleur, donc le lien ionique en Alpo4 Il devrait être plus fort que dans toutes les options ci-dessus.
Et enfin, nous avons le gagnant PB3P4, Eh bien, si nous supposons qu'il est formé par des ions, ils deviennent PB4+ Et P3-. Leurs charges ont les plus grandes amplitudes; Et donc, PB3P4 C'est le composé qui a probablement le lien ionique le plus fort.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Liaison ionique. Récupéré de: dans.Wikipédia.org
- Helmestine, Anne Marie, Ph.D. (11 février 2020). Ionic vs liaisons covalentes - Comprendre la différence. Récupéré de: Thoughtco.com
- Les éditeurs d'Enyclopaedia Britannica. (31 janvier 2020). Obligation ionique. Encyclopædia Britannica. Récupéré de: Britannica.com
- Chimicool dictionnaire. (2017). Définition du lien ionique. Récupéré de: Chemicool.com
- « Granrataria Balance Caractéristiques, pièces et comment l'utiliser
- Modèle atomique de Rutherford History, expériences, postulats »

