Inertie chimique

- 996
- 27
- Justine Charpentier
Qu'est-ce que l'inertie chimique?
L'inertie chimique est la propriété qui a une substance ou un matériau pour résister à la dégradation causée par des agents externes. En ce sens, ses propriétés physiques et, en particulier les produits chimiques, restent inchangés. Il n'y a pas de pauses de lien ou de formation de nouveaux.
Maintenant, l'inertie chimique est relative. Certaines substances ou matériaux sont plus inertes que d'autres, ce qui est dû à la nature et à la force de leurs interactions. Comme cela pourrait, en principe, contraster les phénomènes de changement, indispensables pour que la matière évolue dans divers produits.
 Un coup de pied d'or. L'or est de la corrosion plus résistant en métal
Un coup de pied d'or. L'or est de la corrosion plus résistant en métal C'est pourquoi, cependant inerte qu'il s'agit d'une substance ou d'un matériau, il y aura toujours une condition dans laquelle il deviendra réactif. Par exemple, l'or est le plus noble des métaux et est considéré comme inerte. Cependant, il est attaqué et dissous par Royal Water, une solution à laquelle il est très réactif.
Peut-être, et à ce jour, le seul élément chimique qui a démontré une inertie chimique absolue est le néon. Aucun composé n'est connu, même pas dans des conditions ultrapresures, comme celles des noyaux des planètes ou des lunes.
Caractéristiques de l'inertie chimique
Manque d'oxydation
Pour qu'un matériau ou une substance soit inerte, en principe, il ne doit pas réagir avec l'air environnant. Cela signifie qu'il n'a pas tendance à former des liens avec des molécules d'oxygène ou d'azote qui entourent sa surface. En d'autres termes: ne pas oxyder l'exposition à l'air.
La nourriture et toutes les substances biologiques en question ont tendance à s'oxyder. On dit donc qu'ils ne sont pas inertes.
Le manque d'oxydation dans l'inertie chimique doit être maintenu à des températures supérieures à 100 ºC. Plus la température est élevée, plus.
Résistance acide ou alcalis
Une autre caractéristique présente dans l'inertie chimique est la résistance aux acides ou aux bases. Cela signifie qu'une substance ou un matériau inerte devrait résister à l'attaque des acides, sans tendance à se dégrader par l'acceptation des ions H+ ou des électrophiles très forts; ou l'attaque des bases, sans dégrader à cause des ions OH-.
Il peut vous servir: acide perbromique (HBRO4): propriétés, risques et utilisationsEncore une fois, c'est relatif, car il existe différents types d'acides et de bases. Certaines substances inertes peuvent être très résistantes à l'acide sulfurique, mais elles sont dégradées au lieu de la baisse plus faible de l'acide fluorhoride. Tel est le cas des bouteilles en verre lorsqu'ils réagissent avec HF.
Stabilité électronique
Les caractéristiques ci-dessus ont à voir avec la stabilité thermodynamique dérivée de la nature des interactions intermoléculaires, en plus d'autres facteurs. D'un autre côté, l'inertie chimique est également aperçue dans les caractéristiques électroniques des mêmes atomes.
Plus la configuration électronique d'un atome est stable, plus sa tendance à gagner ou à perdre des électrons. Par conséquent, il présentera une plus grande inertie chimique. C'est le cas des gaz nobles, qui seront vus dans la section suivante.
Bioinactivité
En médecine, une substance ou un matériau est inerte s'il manque de bioactivité. C'est-à-dire qu'il peut être situé à l'intérieur d'un organisme sans être assimilé pendant son métabolisme. Cette caractéristique est très souhaitable dans les prothèses osseuses ou dans la reconstruction des tissus.
Résistance au rayonnement
Enfin, les substances ou les matériaux inertes doivent également être résistants aux rayonnements, être ultraviolets ou nucléaires.
Exemples d'inertie chimique
Verre
 Le verre est un matériau relativement inerte
Le verre est un matériau relativement inerte Parmi les exemples de matériaux qui présentent une inertie chimique, nous avons le verre. S'ils n'étaient pas inertes, ils ne serviraient pas à l'élaboration de conteneurs ou de conteneurs, car ils réagiraient avec leur contenu. Selon leur composition, comme les borosilicats, ils peuvent devenir très résistants à la corrosion et à la température.
Cependant, comme mentionné au début, le verre n'est pas à l'abri de toutes les substances: il réagit avec le HF, même dilué, des alcalis chauds, comme NaOH et H3Pote4 Très concentré et chaud.
Peut vous servir: pyrolysePlastiques
 Si la casserole de Teflon n'était pas inerte, cela gâcherait tous les aliments que nous y avons cuits. Source: Mdevicente, CC0, via Wikimedia Commons
Si la casserole de Teflon n'était pas inerte, cela gâcherait tous les aliments que nous y avons cuits. Source: Mdevicente, CC0, via Wikimedia Commons Les plastiques remplissent également des fonctions similaires à celles du verre, mais il y a beaucoup plus de polyvalence (ils ne se cassent pas si facilement). Certains plastiques, tels que le téflon (polytétrafluoroéthylène), le kynar (fluorure de polyvinylidène) et Telene (polydicyclopentadiène), sont extrêmement résistants à l'attaque des acides et de la corrosion.
Céramique
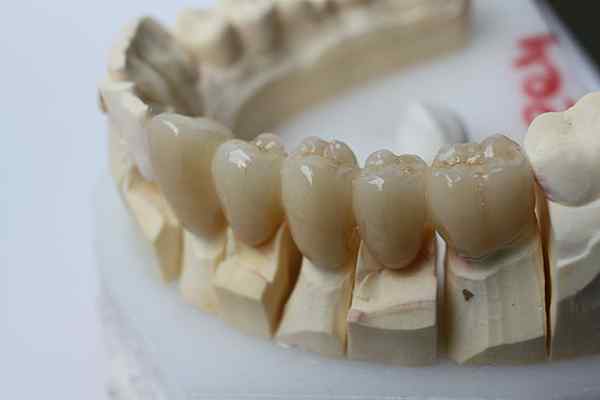 L'inertie chimique de la zircone lui permet d'être utilisée pour les prothèses dentaires. Source: bin im garten via wikipedia.
L'inertie chimique de la zircone lui permet d'être utilisée pour les prothèses dentaires. Source: bin im garten via wikipedia. La céramique inerte va un pas plus loin que les plastiques. Ils sont destinés aux applications où les températures élevées prédominent, tout à fait habituelles dans l'industrie automobile et aérospatiale; ou dans les systèmes biochimiques, comme dans l'industrie pharmaceutique et dans la mise en œuvre de prothèses osseuses.
Parmi certaines de ces céramiques avec une grande inertie chimique que nous avons: l'alumine (à2SOIT3, Présent dans le Corindon et le Sapphire), les silicates (verre spécialisé), le carbure de silicium (sic, dur et tenace) et la zircone (Zio2).
Des gaz inertes
Laissant les matériaux inertes de côté, nous avons maintenant des substances inertes. Les gaz inertes ne sont pas très réactifs, donc leur présence dans l'air n'implique aucun risque de réaction dans des conditions normales.
Parmi ces gaz, nous avons le CO2, CO et N2. L'azote est le plus inerte de tous ces gaz; Et pourtant, il est capable de réagir chaud avec certains métaux pour former des nituros, m3Nn, être n État d'oxydation de Valence ou du métal.
Le CO2 Il est relativement inerte; sauf lorsqu'il rencontre des solutions alcalines, où elle est transformée en carbonates, ou en présence d'enzymes anhydraiques de charbon.
Pour sa part, le CO reste inerte à température ambiante; Mais à des températures élevées, il réagit avec le charbon, la vapeur d'eau, les oxydes métalliques, les oléfines, entre autres composés.
Peut vous servir: équilibre chimique: explication, facteurs, types, exemplesDe telles réactions peuvent se dérouler en présence de catalyseurs métalliques. De même, le CO, même sans casser ses liaisons covalentes, est capable de coordonner les atomes de métaux neutres.
Métaux nobles
Les métaux nobles sont les plus résistants à la corrosion et à l'attaque des acides et des alcalis. Chacun, à des températures élevées, ou en format de poussière, réagira avec l'oxygène ou le fluorure. Par conséquent, l'inertie chimique de ces éléments est assez relative.
Parmi les métaux nobles que nous avons: Gold (Au), Ruthenio (Ru), Platinum (PT), Paladio (PD), Osmio (OS) et Iridido (IR). De tous, l'or est le plus noble, même dans un état métallique de la croûte terrestre.
gaz nobles
Et enfin, dans le siège le plus élevé de l'inertie chimique, nous avons des gaz nobles: hélium (He), néon (NE), Argon (AR), Crypton (KR), Xenon (XE) et Radon (RN). Tous sont extrêmement inertes. Cependant, de nombreux composés du xénon ont été synthétisés, y compris des sels appelés perxenatos, avec l'anion Xeo64-.
 Les néons correspondent aux éléments chimiques les plus inertes de la nature
Les néons correspondent aux éléments chimiques les plus inertes de la nature Son inertie chimique est parce que leurs atomes contiennent leur énergie et leurs couches orbitales totalement pleines d'électrons. À partir de l'argon, il est possible que sous les ultrapressions, ils accéderont aux électrons en utilisant des couches d'orbitale vide ou plus d'énergie (3D et 4S, par exemple); chose qui est impossible pour l'hélium ou le néon.
De gaz nobles précisément l'hélium et le néon sont les plus inertes. L'hélium est capable de former des composés avec des pressions de sodium à très élevées (Hena).
Pendant ce temps, aucun composé n'est connu du tout, étant encore plus inerte que l'hélium lui-même en raison de sa charge nucléaire plus efficace, qui repousse fortement tout atome qui essaie d'approcher les atomes néon.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorgánI CA. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Chimiquement inerte. Récupéré de: dans.Wikipédia.org
- Docteur. Doug Stewart. (2020). Définition de inerte. Récupéré de: Chemicool.com
- Elsevier B.V. (2020). Inertie chimique. ScienceDirect. Récupéré de: ScienceDirect.com
- Clara Moskowitz. (20 mars 2018). Une surprise de gaz noble: l'hélium peut former des composés étranges. Récupéré de: Américain scientifique.com
- Coorstek. (2020). Propriétés chimiques de la céramique technique. Récupéré de: coorstek.com
- Osborne Industries. (2020). Les 3 plastiques les plus résistants à l'acide. Récupéré de: Osborneindustries.com

