Ion hydronio
- 4617
- 1483
- Anaïs Julien
Quel est l'ion hydronium?
Il Ion hydronio C'est une sorte de charge positive qui résulte de la protonation d'une molécule d'eau, et dont la formule chimique est H3SOIT+. Il se compose de la plus simple des oxoniens: les ions où l'oxygène porte une charge formelle positive et a trois liaisons covalentes.
Le H3SOIT+ C'est l'un des cations les plus simples mais curieux qui existent. Dans l'eau dans des conditions normales, il a une concentration de 1 · 10-7 M, produit de l'équilibre de l'auto-iisation. Cependant, sa concentration augmente de façon exponentielle lorsqu'il est fort3SOIT+ Ils se dissolvent dans l'eau, l'acidifiant.
 Molécule d'ion hydronium
Molécule d'ion hydronium La concentration ou l'activité de H3SOIT+ Dans l'eau, il sert à mesurer l'acidité des solutions aqueuses: pH. Plus il y a d'ions H3SOIT+ Foin, moins positif sera le pH, et plus d'acide sera la solution en question. Cette acidité, en revanche, réside dans l'ion hydrogène, H+, qui est souvent confondu avec ion h3SOIT+.
 Formule ion ou hydronio
Formule ion ou hydronio Le H+ et sa capacité incroyable à transférer entre les ponts d'hydrogène des molécules d'eau permet le H3SOIT+ associé dans des formations de cations plus complexes; comme le cation d'Eigen, h9SOIT4+, et le cation de Zundel, h5SOIT2+, et plein d'autres.
Structure d'ions hydronium
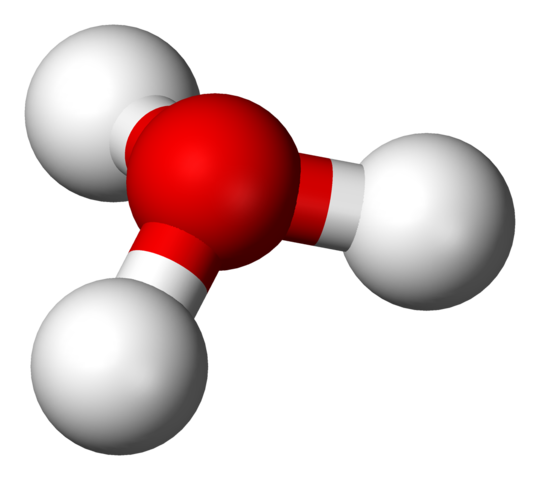 Structure H3O + avec un modèle de sphères et de barres
Structure H3O + avec un modèle de sphères et de barres Dans la première image, vous pouviez voir la formule structurelle de l'ion hydrum. Nous voyons maintenant sa représentation avec un modèle de sphères et de barres. Dans les deux mets en évidence, la géométrie pyramide trigonale, dont les angles de liaison (O-H) sont de 113 °; Un peu détourné de 119º pour le tétraèdre.
Bien que l'oxygène ait une charge partielle positive, cela ne signifie pas que la région négative est autour des atomes d'hydrogène. Tout le contraire. Oxygène en h3SOIT+ Il s'agit d'un produit encore plus électronégatif de sa carence électronique; Ainsi, toute la densité négative visualisée sur une carte de potentiel électrostatique:
Peut vous servir: sulfate de potassium (K2SO4): structure, propriétés, utilisations, synthèse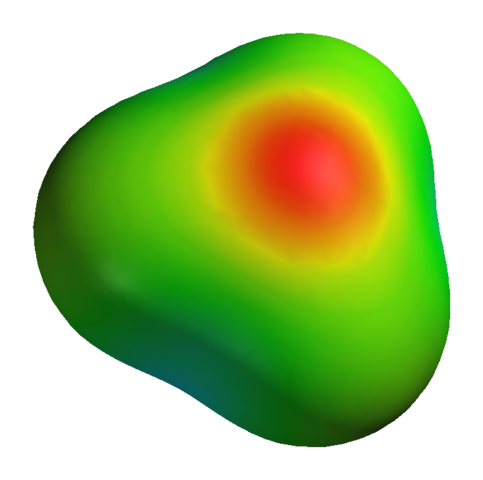 Carte de potentiel électrostatique pour H3O+
Carte de potentiel électrostatique pour H3O+ Sans oublier que l'oxygène a quelques électrons libres, ce qui renforce encore plus de densité négative.
Une conséquence de tout ce qui précède est que les hydrogènes H3SOIT+ Ils perdent la densité électronique, car l'oxygène l'attire vers lui-même. Par conséquent, H3SOIT+ Vous pouvez établir des sources d'hydrogène très fortes avec une molécule d'eau voisine: H2SOIT+-H-oh2.
Cette interaction est la clé de la mobilité ionique incroyable de H+ Et pourquoi h3SOIT+ Il est capable de s'associer à de nombreuses molécules d'eau en même temps.
Acidité
Hydronio Ion est un acide très fort. En fait, c'est l'acide le plus fort qui peut exister en solution aqueuse. Parce que? Parce que tout autre acide plus fort que lui protona une molécule d'eau pour créer H3SOIT+:
Ha + h2O → A- + H3SOIT+
Le H3SOIT+ Il est capable de rester stable chaque fois qu'il n'y a pas d'autres bases dans l'environnement plus fortes que l'eau. Tout acide en a respecté sera classé comme un acide fort. En attendant, si l'acide est plus faible que H3SOIT+, Ensuite, une partie de HA ne sera pas complètement dissociée et nous parlerons d'un acide faible:
Ha + h2Ou ⇌ A- + H3SOIT+
Par conséquent, depuis h3SOIT+ C'est l'acide le plus fort qui existe dans l'eau, l'acidité de cela dépendra de la concentration de H3SOIT+. C'est la base pour définir, en termes simples, l'acidité d'une solution aqueuse exprimée en pH:
pH = -log [h3SOIT+]]
H+ contre. H3SOIT+
L'ion hydrogène et l'hydronium ne sont pas les mêmes. Le H+ C'est beaucoup plus acide que H3SOIT+, Eh bien, il se compose d'un proton rien de plus, qui cherchera une molécule pour gagner des électrons par tous les moyens. Quand h+ obtenir une molécule d'eau formes h3SOIT+:
Il peut vous servir: oxyde de cuprique (CUO)H+ + H2O → H3SOIT+
C'est pourquoi H3SOIT+ peut être représenté comme h+(Ac), indiquant que c'est un H+ En milieu aqueux.
La force d'un acide est mesurée dans sa capacité à faire un don, selon la définition de Brönsted-Lowry, H ions+. À quel point il est fort, plus il donnera+, Pas de h3SOIT+. Les acides les plus forts jamais synthétisés (supercides) sont ceux où H+ Il est "nu"; c'est-à-dire sans aucun obstacle à sauter vers la molécule qui protona.
La pratique de représenter h3SOIT+ cendre+(AC) Il est si courant qu'il y a de nombreuses fois à parler des deux comme s'ils étaient les mêmes, sans cela avoir un impact négatif sur l'interprétation de la chimie des solutions.
Solvatation
Le H3SOIT+ Il peut former des ponts d'hydrogène très forts avec une molécule d'eau voisine. Ce faisant, nous avons le cation de Zundel, h5SOIT2+:
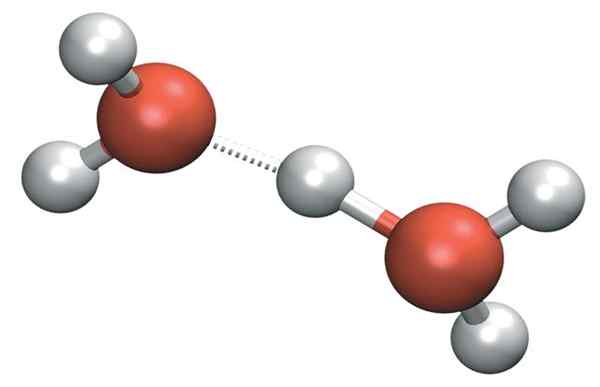 Zundel cation
Zundel cation Mais la charge positive ne reste pas seulement d'un seul côté du cation: cela peut être transféré à l'autre molécule d'eau comme ion h+:
H2Oh-+Oh2 → H2SOIT+-H- oh2
Par conséquent, la charge positive est répartie entre les deux atomes d'oxygène pour les deux molécules d'eau.
Dans le cas du cation propre, h9SOIT4+, un H3SOIT+ Formez des ponts d'hydrogène avec trois molécules d'eau, distribuant parmi eux la charge positive grâce à un «saut» H+. Ces sauts sont si rapides qu'ils expliquent la grande mobilité ionique de H+ Dans l'eau, en utilisant h3SOIT+ comme véhicule et molécules d'eau comme une autoroute.
Le H5SOIT2+ et h9SOIT4+ Ce ne sont pas les seules associations cationiques que H3SOIT+ peut provenir de l'eau. Certains calculs de dynamique moléculaire démontrent l'existence d'un cluster H3SOIT+(H2SOIT)vingt: 20 h molécules2Ou interagir avec un cation h3SOIT+ et en distribuant parmi eux la charge positive.
Peut vous servir: néodyme: structure, propriétés, utilisationsPar conséquent, H3SOIT+ et h+ Ils construisent une relation curieuse avec les molécules d'eau, au-delà de l'acidité.
Vous sortez
Tout comme les salles oxy biologiques existent, cela ne fait pas exception avec Oxy dérivé de la protonation de l'eau. Sa formule générale est [h3SOIT+] [X-], Où x- C'est tout anion qui vient de la dissolution d'un acide très fort.
Ces sels reçoivent parfois le nom des «acides monohydratés», car la formule [H3SOIT+] [X-] ou h3SOIT+· X- Il peut également être écrit comme hx · h2SOIT. Ainsi, il peut y avoir des acides dihydratés, Hx · 2H2Ou, trihydrates, hx · 3h2Ou, etc.
Par exemple, HCL peut cristalliser comme HCl · H2OH3SOIT+· CL-. Nous avons également d'autres sels d'hydronium tels que H3SOIT+· CLO4- ou hclo4· H2Ou, et hbr · 4h2OH3SOIT+· Br-· 3h2SOIT.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Fhiver & Atkins. (2008). Chimie inorgánI CA. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Hydronium. Récupéré de: dans.Wikipédia.org
- Avneet Kahlon et Stephen Lower. (15 août 2020). L'ion hydronium. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Helmestine, Anne Marie, Ph.D. (25 août 2020). Définition de l'ion hydronium. Récupéré de: Thoughtco.com
- Les éditeurs d'Enyclopaedia Britannica. (2020). Ion hydrogène. Récupéré de: Britannica.com

