Groupe hydroxyle

- 941
- 177
- Jade Duval
Nous expliquons ce qu'un groupe hydroxyle, ses caractéristiques, sa structure et plusieurs exemples est
 Structure chimique du groupe hydroxyle
Structure chimique du groupe hydroxyle Qu'est-ce qu'un groupe hydroxyle?
UN Groupe hydroxyle Il s'agit d'un groupe fonctionnel ou d'une partie d'autres groupes fonctionnels présents dans de nombreux composés organiques et inorganiques. Il est formé par un atome d'hydrogène et un d'oxygène (d'où son nom).
Les groupes hydroxyles sont généralement liés à un atome de carbone ou à un autre élément non métallique tel que le soufre ou le phosphore, entre autres, et sont l'un des groupes fonctionnels les plus importants en chimie organique.
Ce groupe d'atomes est présent dans des groupes fonctionnels organiques tels que les alcools, les phénols et les acides carboxyliques, et est celui qui donne à chacun de ces groupes fonctionnels ses propriétés chimiques caractéristiques caractéristiques caractéristiques. Dans différentes structures, il peut être représenté comme -oh ou ho-
Caractéristiques des groupes hydroxyles
- Il se compose d'un atome d'oxygène et d'un hydrogène lié les uns aux autres et lié à un autre atome dans une molécule à travers des liaisons covalentes.
- Le lien entre l'hydrogène et l'atome d'oxygène est une liaison polaire dans laquelle l'oxygène a une charge partielle négative et un hydrogène de charge partielle positive, ce qui fait du groupe hydroxyle un groupe fonctionnel polaire.
- Il a une structure similaire à celle de l'eau. Pour cette raison, bon nombre des composés qui le contiennent sont généralement solubles dans ledit solvant.
- Il a un hydrogène directement lié à l'atome d'oxygène, de sorte que le groupe hydroxyle peut former une liaison hydrogène dans laquelle il participe en tant que groupe d'hydrogène donneur.
- Ayant deux électrons libres sur l'atome d'oxygène, le groupe hydroxyle peut former deux liaisons hydrogène supplémentaires agissant comme accepteur des atomes d'hydrogène.
- Vous pouvez agir comme un acide en donnant un proton à une base. Selon le groupe fonctionnel dont il fait partie et l'atome auquel il est directement lié, le groupe hydroxyle peut montrer différents niveaux d'acidité. Par exemple, dans les alcools, il a une PKA de 15 ou plus (acide féroce que d'eau), en phénols, il varie entre 7 et 10 tandis que dans les acides carboxyliques, il se situe généralement entre 4 et 5.
- Vous pouvez également agir comme une base de Lewis, donnant l'une de ses paires d'électrons pour être liée à un autre proton ou à un autre acide Lewis.
Structure du groupe hydroxyle
Comme mentionné parmi les caractéristiques, l'oxygène et les atomes d'hydrogène dans le groupe hydroxyle forment une liaison covalente polaire.
De plus, l'atome d'oxygène forme une deuxième liaison covalente avec un autre atome qui fait partie d'une molécule comme alcool, phénol à un autre composé. La structure Lewis de ce groupe est présentée ci-dessous:
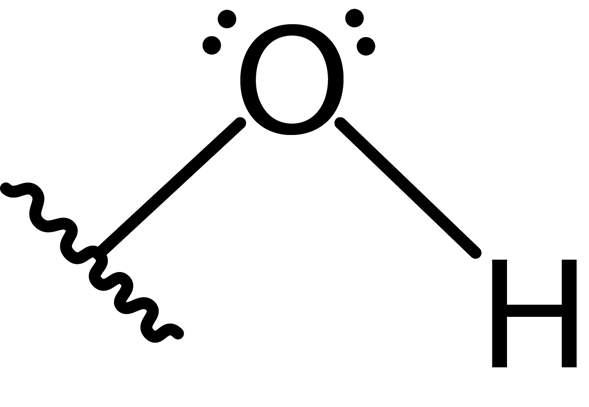
En raison de la présence des deux paires d'électrons libres sur l'atome d'oxygène et des deux liaisons covalentes, le groupe hydroxyle a une géométrie angulaire avec un angle d'environ 104 °, légèrement inférieur à l'angle tétraédrique. La longueur de la liaison d'oxygène-hydrogène est d'environ 0.97 Angstroms.
Groupe hydroxyle, radical hydroxyle et anion hydroxyde
Il est très courant de confondre le groupe hydroxyle avec un radical hydroxyle et un anion hydroxyde, car tous sont formés par les deux mêmes atomes, cependant, ces termes ne se réfèrent pas à la même.
D'une part, le radical hydroxyle diffère du groupe hydroxyle dans lequel il est un radical libre avec un nombre impair d'électrons de valence, et n'est pas non plus lié à aucun autre atome ou groupe d'atomes (c'est pourquoi il est dit gratuit).
Malgré ces différences, de nombreuses personnes utilisent à tort le terme radical hydroxyle pour désigner le groupe hydroxyle lorsqu'il est présent dans une molécule.
L'anion d'hydroxyde, en revanche, est un ion avec une charge négative formée d'hydrogène et d'oxygène, tandis que le groupe hydroxyle est un groupe neutre.
De plus, alors que le groupe hydroxyle est toujours lié à une molécule au moyen d'une liaison covalente, les composés contenant des ions hydroxyde ont une liaison ionique entre ceci et certains métaux tels que le sodium, le lithium ou le potassium.
Peut vous servir: quelle est l'anode et la cathode?Exemples de groupe hydroxyle
Alcools
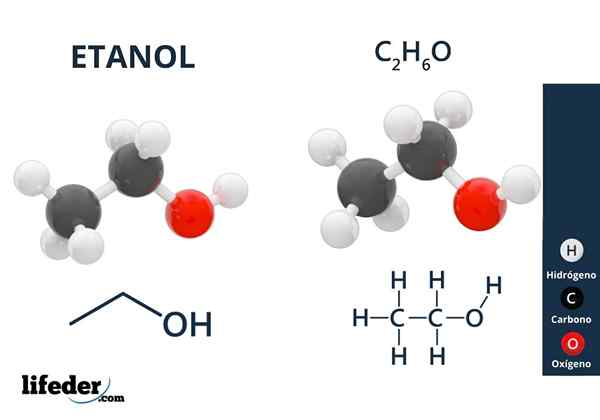 Éthanol
Éthanol Les alcools ont des groupes hydroxyles liés à un carbone aliphatique. Des exemples d'alcools sont:
- Alcool méthylique.
- Éthanol.
- Alcool isopropylique.
Phénols
Les phénols sont caractérisés par un groupe hydroxyle directement lié à un anneau aromatique. Quelques exemples de phénols communs sont:
- Phénol.
- Alfa et bêta-naftol.
- Ortho, objectif et pour Cresol.
Les glucides
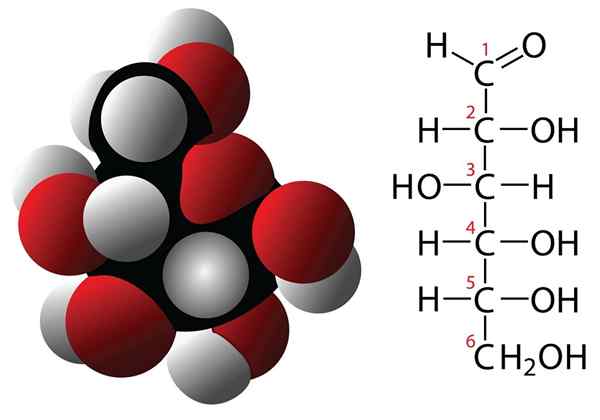 Molécule de formule de glucose et moléculaire
Molécule de formule de glucose et moléculaire Les glucides sont des composés avec 3 atomes de carbone ou plus qui sont caractérisés par une formule empirique formée par des carbones et des molécules d'eau. Ces composés ont souvent plusieurs groupes d'hydroxilli, ce qui les rend très solubles dans l'eau. Quelques exemples de glucides sont:
- Glucose.
- Fructose.
- Saccharose.
Acides carboxyliques
Le groupe fonctionnel carboxyle présent dans les acides carboxyliques correspond à l'un des groupes fonctionnels les plus acides qu'une molécule organique puisse avoir. Ces composés sont généralement des acides faibles lorsqu'ils les comparent avec certains acides minéraux, mais ils peuvent devenir considérablement acides en fonction de leur structure.
L'acidité du groupe carboxyle est due à la présence d'un groupe hydroxyle lié à un groupe carbonyle, qui stabilise la charge négative de l'anion qui se forme lorsque l'hydroxyle donne son proton. Quelques exemples d'acides carboxyliques sont:
- Acide acétique.
- Acide benzoique.
- L'acide trifluoroacétique.
Acides sulfoniques
Les acides sulfoniques sont des composés organiques formés par la réaction entre certains composés organiques et l'acide sulfurique ou le dioxyde de soufre. Ces types de composés ont un groupe hydroxyle et, en général, sont des acides assez forts, comparables à l'acide sulfurique.
Quelques exemples d'acides sulfoniques sont:
- Acide pentosulfonique.
- Ortho, objectif et isomères d'acide toluensulfonique.
- Acide benzeulfonique.
Acides inorganiques
Les groupes hydroxyles apparaissent non seulement dans les composés organiques. De nombreux composés inorganiques les possèdent également, en particulier les acides oxacides. Dans ces cas, le groupe hydroxyle est directement lié à un non-métal, généralement différent du carbone.
Quelques exemples d'acides inorganiques qui ont des groupes hydroxyle ainsi que le non-métal auquel il est lié sont:
- Acide hypochlouleux, dans lequel le groupe hydroxyle est lié à un atome de chlore.
- L'acide sulfurique, qui a deux groupes hydroxyles liés à un atome de soufre.
- Acide phosphorique, dans lequel les trois groupes hydroxyles sont liés à un atome de phosphore.

