Chloro acide (HCLO2)
- 3160
- 964
- Raphaël Charles
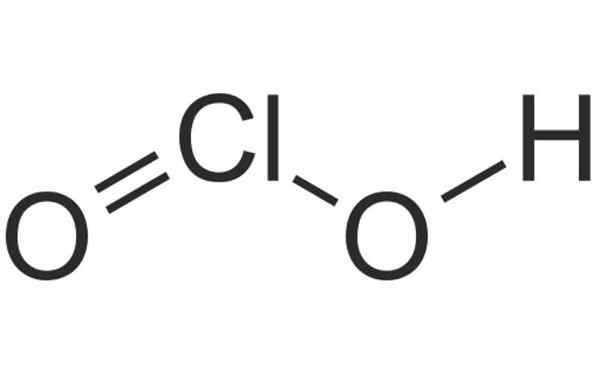
 Structure chimique de l'acide chloré. Source: HBF878, Wikimedia Commons
Structure chimique de l'acide chloré. Source: HBF878, Wikimedia Commons Qu'est-ce que le chloro?
Il Chloro acide C'est un composé inorganique de la formule HCLO2. Cet acide est l'un des acides oxacides du chlore, où il se trouve avec l'état d'oxydation 3+.
Bien que l'acide soit difficile à obtenir en substance pure, la base conjuguée dérivée de ces acides, l'ion chlorite, est stable. Un exemple de sel de cet anion est le chlorite de sodium. Ce sels et d'autres sels connexes sont parfois utilisés dans la production de dioxyde de chlore.
Le chloro acide est un acide faible. La substance pure est instable, disproportionnée avec de l'acide hypoclory (statut d'oxydation CL +1) et de l'acide chlorique (état d'oxydation CL +5):
2hclo2 → HCLO + HCLO3
Le chloro acide est obtenu, avec l'acide chlorique, dans la décomposition de la solution aqueuse de dioxyde de chlore.
La solution d'acide chloro a d'abord été obtenue en réduisant l'acide chlorique avec de l'acide tartrique, cependant, la principale méthode d'obtention de cet acide est de traiter une suspension de chlorure de baryum avec de l'acide sulfurique:
BA (CLO2)2 + H2Swin4 → Baso4 + 2hclo2
Le chloro acide est un puissant agent oxydant, bien que sa tendance à la diffusion ou à la disproportion contrecarre son potentiel oxydant.
Le chlore est le seul halogène qui forme une formule isolable acide hxo2. Ni l'acide courageux ni l'acide d'iodose n'ont été isolés. Certains sels d'acide de blague, les blagues sont connues, mais, sauf en tant qu'intermédiaires dans les réactions, il n'y a pas de sels yoditos.
Proprietes physiques et chimiques
- Le chloro acide, lorsqu'il est possible d'isoler, est un liquide incolore sans arôme caractéristique.
Il peut vous servir: cycloalcinos- Le composé a un poids moléculaire de 68 456 g / mol. Il a un point d'ébullition (calculé) de 502,07 ° C et une solubilité d'eau 1 × 10 (calculée)6 mg / l.
- Le hclo2 Il est instable en raison de la réaction de dissutation (ou de la disproportion) de produire de l'acide chlorique et hypocléreux, similaire à celui des acides analogiques de brome et d'iode:
2hclo2 → HCLO + HCLO3
- L'acide chloro est considéré comme un acide faible, bien que sa constante de dissociation soit à l'ordre de 1 x 10-2, Ce qui ne le fait pas aussi faible que les autres acides ayant un PKA de 1,96.
Des risques
Le chloro acide est un composé instable et un fort agent oxydant incompatible avec des agents réducteurs et des alcalis.
Le chloro acide est irritant en cas de contact avec la peau et les yeux, et est dangereux en cas d'ingestion et d'inhalation.
En cas de contact visuel, vous devez vérifier si les lentilles de contact sont utilisées et les retirer immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. L'eau froide peut être utilisée, mais pas une pommade oculaire.
Si le produit chimique entre en contact avec les vêtements, conservez-le le plus rapidement possible, en protégeant ses propres mains et son corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule dans la peau exposée de la victime, comme les mains, la peau contaminée par de l'eau courante et du savon non abrasif est doucement lavée et soigneusement.
L'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Laver les vêtements contaminés avant de l'utiliser à nouveau.
Peut vous servir: groupe de phosphateSi le contact de la peau est grave, il doit être lavé avec un savon désinfectant et couvrir la peau contaminée par une crème antibactérienne.
En cas d'inhalation, la victime devrait être autorisée à se tenir dans une zone bien ventilée. Si l'inhalation est grave, la victime doit être évacuée dans une zone sûre dès que possible. Vêtements serrés en vrac, comme le cou de chemise, les ceintures ou la cravate.
Si la victime est difficile à respirer, l'oxygène doit être administré. Si la victime ne respire pas, une réanimation buccale est faite. Compte tenu toujours de prendre en compte que cela peut être dangereux pour la personne qui fournit une aide à la réanimation bouche à bouche lorsque le matériau inhalé est toxique, infectieux ou corrosif.
En cas d'ingestion, il n'induit pas de vomissements. Desserrer les vêtements serrés. Si la victime ne respire pas, faites la réanimation buccale de la bouche. Dans tous les cas, des soins médicaux immédiats doivent être recherchés.
Applications
- Des études ont été menées lorsque des solutions méta-stables d'acide chlore / d'oxyde de chlore telles que le rinçage oral pour la réduction des plaques.
L'étude a été réalisée à un groupe de 18 à 27 ans. Son effet sur le développement de l'assiette et le nombre de bactéries salivaires a été testé, obtenant une réduction de jusqu'à 34,5% de réduction des scores de la plaque dentaire par rapport à un groupe placebo.
- Le chloro acide est impliqué dans la préparation du chlorite d'acide de sodium, qui possède des propriétés antimicrobiens et est conçu pour une utilisation principalement comme pulvérisation ou solution d'immersion pour la volaille, les viandes, les légumes, les fruits et les aliments marins. Il est également utilisé dans l'eau de refroidissement des oiseaux Corral.
Peut vous servir: orbitales dégénérées- Le chlorite de sodium est produit par l'ajout d'acide de qualité alimentaire (par exemple, l'acide citrique, l'acide phosphorique, l'acide chlorhydrique, l'acide roue ou le sulfate de sulfate d'hydrogène) en une solution aqueuse de chlorite de sodium (NaClo2).
La combinaison d'acide avec la solution de chlorite de sodium entraîne une conversion de chlorite en acide de chloro mètre (HCLO2).
Naclo2 + H+ ⇌ HCLO2 + N / A+
Cette solution peut par la suite former un mélange avec du chlorite (CLO2-), dioxyde de chlore (CLO2) et le chlorure (CLM). La réaction génère une solution oxydative avec des espèces oxychlores aux propriétés antimicrobiennes.
- Le chlorite d'acide de sodium est conçu pour être utilisé dans le cadre d'une approche intégrée axée sur le contrôle des charges microbiennes dans les aliments.
La solution de chlorite à l'acide de sodium agit pour réduire le nombre d'agents pathogènes (par exemple, Escherichia coli, ET. Coli O157: H7, Salmonella spp., Campylobacter spp., et Listeria monocytogenes).
Les références
- Acide chloreux. Récupéré d'EBI.CA.ROYAUME-UNI.
- Centre national d'information sur la biotechnologie. Récupéré de pubchem.

