Oxydes de base

- 2464
- 228
- Prof Ines Gaillard
Nous expliquons quels sont les oxydes de base, comment se forment leurs propriétés, la nomenclature et donnent plusieurs exemples,
 De nombreux oxydes de base ont des couleurs métalliques frappantes, caractéristiques
De nombreux oxydes de base ont des couleurs métalliques frappantes, caractéristiques Quels sont les oxydes de base?
Les oxydes de base Ce sont des composés inorganiques formés par l'union entre l'oxygène et un métal. Ils sont appelés oxydes de base car ils produisent des solutions alcalines ou de base lors de la dissolution dans l'eau. Également parce qu'ils réagissent avec les acides pour former un sel et de l'eau à travers une réaction de neutralisation acide-base.
Les oxydes de base sont très courants. En fait, la plupart des métaux dans la nature se trouvent dans les sols d'oxydes, ils s'appelaient donc des terres.
Les oxydes de base sont d'une grande importance pour l'industrie. De nombreux pigments colorés utilisés dans l'industrie sont des oxydes. D'autres oxydes sont utilisés comme base pour les peintures, en particulier le titane, le plomb et les oxydes de zinc.
Propriétés de base des oxydes
Ce sont des composés binaires
Ces composés ne sont formés que par deux éléments: l'oxygène et un métal. Par conséquent, ce sont des composés binaires.
Sa formule empirique est m2SOITX ou moX / 2
La valence de l'oxygène dans les oxydes est toujours -2, donc les formules empiriques des oxydes sont simplifiées lorsque le Valencia métallique est un numéro de couple. Cependant, la même chose ne se produit pas quand c'est étrange.
Par exemple, la formule empirique de l'oxyde de sodium est na2Ou parce que le sodium a Valencia +1 (impair). Au lieu de cela, la formule empirique de l'oxyde de calcium est CAO, car le calcium a Valencia +2.
Ce sont des composés inorganiques, presque toujours ioniques
La plupart des oxydes basiques sont des composés ioniques cristallins. Cela comprend les oxydes de tous les métaux alcalins, de tous les alcalineurs (à l'exception du béryllium) et de la première série de métaux de transition.
Peut vous servir: liaison chimiqueIls ont des points de fusion et d'ébullition très élevés
Le lien ionique conserve tous les ions qui forment des oxydes de base fortement unis. Cela les rend difficiles à faire fondre et encore plus difficiles à vaporiser. Pour cette raison, ils ont des points de fusion et d'ébullition très élevés.
Ils sont solides à température ambiante
En raison du même fait d'avoir des points de fusion élevés, tous les oxydes de base sont solides à température ambiante.
Ce sont des composés de base
La raison pour laquelle ils sont appelés oxydes de base est précisément en raison de ses propriétés acides-base. Les oxydes à caractère ionique plus élevé produisent des solutions de base lors de la dissolution dans l'eau et réagissent également avec les acides, en les neutralisant.
Cependant, il convient de noter que tous les oxydes métalliques ne sont pas basiques. Certains sont neutres, d'autres acides et autres amphotateurs.
La plupart sont peu solubles ou insolubles dans l'eau
Tous les oxydes de base sont insolubles dans l'eau, à l'exception des oxydes de métaux alcalins et de baryum. Cependant, ils sont solubles dans des solutions acides.
Comment sont les oxydes de base?
Les oxydes de base peuvent se former spontanément lorsque les métaux sont exposés à l'oxygène d'air. En fait, les couches de corrosion formées à la surface des métaux sont constituées de différents oxydes de base.
Le métal impliqué, en général, il s'agit d'un métal alcalin, alcalin ou d'un métal de transition.
Vous pouvez écrire trois réactions générales pour la formation d'oxydes, selon que le Valencia en métal est uniforme ou étrange:
Pour les métaux avec des valences étranges:
Lorsque le métal a une valence impair, la réaction générale de la formation d'oxyde est:

Par exemple, pour la formation d'oxyde de sodium, où le sodium a Valencia +1, la réaction est:
Il peut vous servir: phosphore: histoire, propriétés, structure, obtention, utilisations
Un autre exemple est la formation d'oxyde ferrique, dans lequel le fer a l'oxydation ou la valence +3. Dans ce cas, la réaction est:

Pour les métaux avec Valencia +2:
Lorsque le métal a Valencia +2, la réaction générale de la formation d'oxyde est:

Par exemple, dans le cas de la formation d'oxyde de calcium, où le calcium a Valencia +2, la réaction est:

Pour les métaux avec d'autres paires:
Lorsque le métal a même des valences en plus de +2, la réaction générale de la formation d'oxyde est:
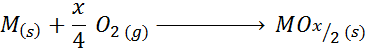
Un exemple de ce cas est la réaction de formation d'oxyde de titane (IV):

Nomenclature de base des oxydes
Il existe trois systèmes de nomenclature pour les oxydes de base qui sont: la nomenclature traditionnelle, le stock et le systématique.
Pour nommer un oxyde selon les deux premiers systèmes de nomenclature, il est nécessaire de connaître le Valencia en métal, tandis que pour le dernier.
Nomenclature traditionnelle
Selon la nomenclature traditionnelle, les oxydes de base sont nommés commençant par le mot soitXido suivi du nom de cation. Ce nom de famille est construit en plaçant la racine du nom métallique et un système de préfixes et de suffixes indiqués par le Valence en métal:
Oxyde + Prefix-Raí-Sufijo
Les règles pour attribuer des préfixes et des suffixes sont résumés dans le tableau suivant:
Nombre de valences possibles | Valence | Préfixe | Suffixe |
1 Valence unique | |||
Seul | --- | ___ico | |
2 Valencias | |||
Âgé | --- | ___ico | |
Mineure | --- | ___ours | |
3 valences | |||
Âgé | --- | ___ico | |
Intermédiaire | --- | ___ours | |
Mineure | Hoquet___ | ___ours | |
4 valences | |||
Âgé | Par___ | ___ico | |
Intermédiaire majeur | --- | ___ico | |
Intermédiaire mineur | --- | ___ico | |
Mineure | Hoquet___ | ___ico |
Exemple:
Il Foi2SOIT3 C'est un oxyde de fer avec Valencia +3. Le fer n'a que deux valences qui sont +2 et +3, donc dans cet oxyde, le fer a la plus ancienne de deux valences. Pour cette raison, le suffixe est ajouté ___ico à la racine du nom du métal de fer qui est Fouler-.
Il peut vous servir: pas d'électrolytes: caractéristiques et exemplesPar conséquent, le nom traditionnel de Foi2SOIT3 est: Oxyde ferrique.
Nomenclature des stocks
Dans ce système, le nom est construit à partir des mots oxyde de, suivi du nom du métal. Enfin, son Valence est placé en nombre romain entre parenthèses:
Métal + nom oxyde (Valencia)
Dans le cas où le métal n'a qu'une seule valence, il est omis.
Exemple:
Dans Cr2SOIT3 Chromium a Valencia +3, donc le nom de nom est Oxyde chromé (III).
Nomenclature systématique
C'est le seul des trois nomenctures qui ne spécifient pas le métal Valence. Les noms sitematiques indiquent le nombre d'atomes d'oxygène et de métal contiennent le composé en utilisant des préfixes numériques.
Le nom est construit avec le mot oxyde précédé par lui préfixe indiquant le nombre d'oxygène, Puis l'article de suivie par Nom du métal avec son préfixe respectif.
Préfixe-oxyde + de + préfixe-métal
Certains préfixes sont:
Le numéro | Préfixe |
1 | Chignon |
2 | A donné |
3 | Tri |
4 | Tétra |
5 | Penta .. |
Exemple:
Dans la nomenclature systématique, le CR2SOIT3 Il s'appelle le trioxyde de dichroma, car il a trois oxygène et deux chromos.
Exemples d'oxydes de base
- Oxyde de sodium - Na2SOIT
- Oxyde ferrique - Foi2SOIT3
- Monoxyde de fer - moche
- Oxyde cromique - cr2SOIT3
- Divanadio pentaoxyde - V2SOIT5
- Oxyde de potassium - k2SOIT
- Oxyde de baryum - Bao

