Tacherie de Wright
- 3585
- 507
- Anaïs Julien
 Diverses smesss sanguins périphériques teints avec une tache de Wright. POUR. Leucémie aiguë B. Plasmodium vivax dans l'érythrocyte. C. Plasmodium falciparum, macrogametocito. D. Lymphocyte
Diverses smesss sanguins périphériques teints avec une tache de Wright. POUR. Leucémie aiguë B. Plasmodium vivax dans l'érythrocyte. C. Plasmodium falciparum, macrogametocito. D. Lymphocyte Quelle est la tache de Wright?
La Tacherie de Wright Il s'agit d'une technique de coloration créée par le pathologiste américain James Homer Wright en 1902, basé sur la coloration de Romanowsky, pour mieux différencier différents types de cellules sanguines.
Cette coloration est polychromatique, ce qui signifie qu'il génère plusieurs couleurs en fonction de la structure qui absorbe le colorant. Cette technique de coloration a été largement utilisée pour effectuer des globules blancs différentiels et étudier la morphologie des globules rouges, des plaquettes et des leucocytes dans le sang périphérique et la moelle osseuse.
Son application est très importante, car des anomalies peuvent être observées dans les différentes lignées cellulaires du sang, facilitant le diagnostic de maladies telles que la leucémie ou les infections bactériennes ou parasites.
Ce sont peut-être les applications les plus courantes dans lesquelles cette technique est utilisée, cependant, elles ne sont pas les seules. Il est également utile dans d'autres échantillons autres que le sang et la moelle osseuse, comme les échantillons de sécrétion nasale, le mucus fécal, les expectorations, la peau, entre autres.
Fondation de la tache de Wright
La tache de Wright est née de la tache Romanowsky.
Le mélange de colorants utilisés dans la coloration de Wright provoque l'effet connu sous le nom de Romanowsky, c'est-à-dire qu'il fournit une belle coloration violette aux noyaux leucocytes et les granules neutrophiles, tandis que les globules rouges sont teints roses roses.
Les composants chargés de donner la gamme des couleurs typiques de la coloration de Wright sont le bleu B et l'Eosina et. L'effet observé dépendra du lien des colorants aux structures chimiques et aux interactions du bleu B et de l'éosine et.
Les structures acides, telles que les acides nucléiques, les protéines nucléaires et le cytoplasme réactif immature de certains types de cellules, set Blue B (coloration de base).
Alors que les structures de base, telles que l'hémoglobine, les granules des éosinophiles segmentés, entre autres structures cellulaires, ont réglé l'éosine et (coloration acide).
Le résultat de la coloration peut être influencé par différents facteurs, tels que le pH du colorant Wright, la solution d'amortissement et de lavage, ainsi que par le temps de coloration et de fixation.
Par conséquent, chaque étape dans la préparation des réactifs est cruciale et doit être faite en prenant soin de chaque détail.
Matériaux
Colorant Wright. Pour 100 ml, il est nécessaire:
Peser 0.3 GR du colorant Wright, mesure 97 ml de méthanol et 3 ml de glycérol.
préparation
Dans un mortier, la lourde quantité de colorant de Wright et incorpore progressivement du glycérol jusqu'à ce que la poussière soit totalement dissoute.
Par la suite, du méthanol est ajouté, mélangé et versé dans une bouteille ambrée.
Avant l'utilisation, la solution avec des mouvements et un filtre doux doit être agité.
Peut vous servir: sélection directionnelle: qu'est-ce que la définition, des exemplesSolution tampon tamponnée
Dans un litre d'eau distillée, 3,76 g d'hydrophosphate de disodium est ajouté (na2HPO4 2h20) plus 2,1 GR du phosphate de potassium dihydrogène (KH2Pote4).
Mélanger très bien jusqu'à ce que vous dissoudiez tous les réactifs incorporés. Ajustez le pH à 7.2. Verser dans un bocal en verre et garder à température ambiante.
Matériaux supplémentaires nécessaires pour effectuer une coloration
De plus, d'autres matériaux sont nécessaires pour effectuer la technique de coloration, ce sont: des objets Porta ou couvrent des objets, un pont de coloration, des bandes avec de l'eau ou du tampon pour le lavage, un chronomètre pour prendre des temps de couleur et un matériau de séchage (papier absorbant, gaze ou coton ).
Composants de coloration de Wright
Méthanol
L'alcool (méthanol) sert de fixateur du frottis de sang à la diapositive.
Fondamentalement, c'est un fixateur réactif, déshydrateur et coagulant réductif. Par conséquent, leur fonction est de coaguler les protéines et de les rendre insolubles, mais sans se faire dénaturer.
Le méthanol est le réactif le plus utilisé pour réparer le frottis dans tous les laboratoires, car il fournit de meilleurs résultats que ceux obtenus avec de l'éthanol. La concentration idéale est de 99%.
L'amortisseur
L'amortisseur (solution tamponnée), a la fonction de régler ou de maintenir.
Le passage de la fixation avec les cellules de méthanol déshydrate et l'amortisseur aide à les réhydrater.
Eosina (Y)
Eosina a une affinité pour les composants de base car c'est un colorant acide. Deux types d'éosine sont connus très similaires les uns aux autres, tellement que ce qui peut être utilisé, obtenant le même résultat.
L'un est appelé éosine et éosine jaune ou tétrabromofluorescéine, et l'autre, l'éosine B, l'éritrosine bleuâtre ou la dibromodyitrofluorescéine. Cependant, l'éosine et est celui qui est utilisé le plus fréquemment.
La propriété la plus importante de ce colorant est sa polarité négative, cela le rend attiré par les structures cellulaires avec une charge positive.
Bleu de méthylène
Est le colorant de base. Sa propriété principale est la métacrome, c'est-à-dire que toutes les structures ne seront pas teintes de la même couleur, elle dépendra de la composition chimique des structures qui coloraient.
Certains deviendront clairs ou bleu foncé, et d'autres de lilas de violet foncé ou pâle.
Technique
- Faites l'échantillon étendu pour qu'il y ait un film mince, que ce soit sur une diapositive ou des couvertures.
- Laisser sécher l'air pendant environ 2 heures.
- Placer l'odeur sèche sur le pont de coloration ou le seau de coloration avec l'échantillon étendu vers le haut.
- Couvrir la feuille avec la goutte de gota Wright pour couvrir toute la surface. Laisser l'acte pendant 5 à 8 minutes.
- Le colorant doit complètement couvrir la diapositive, sans se répandre sur les bords. Si pendant le temps de coloration, il commence à s'évaporer, des gouttes supplémentaires doivent être placées.
- Ajoutez par la suite une quantité égale de l'amortisseur, soufflez un peu jusqu'à ce que la luminosité métallique caractéristique apparaisse. Apprivoiser 10 à 15 minutes.
- Laver à l'eau du robinet, en plaçant le jet doux jusqu'à ce que la feuille soit rose.
- Avec une gaze imprégnée d'alcool a éliminé la coloration à la coloration à l'arrière de la diapositive.
- Laissez le frottis sécher avant de placer l'huile d'immersion pour le visualiser au microscope.
Utilisations / applications de la coloration Wright
Hématologie
Il est idéal pour la coloration du sang périphérique.
En raison des propriétés chimiques de cette combinaison de colorants, les structures cellulaires peuvent être facilement reconnues, en mesure de distinguer les différents types de cellules présentes.
Nez qui coule
Cette technique est très utile pour identifier les cellules de sécrétion nasale (cellules épithéliales, éosinophiles segmentés, polymorphonucléaire) dans le diagnostic de la rhinite allergique.
parasitologie
En ce sens, il a été utile pour l'étude de Leishmania SP Dans les histiocytes du tissu cellulaire sous-cutané dans les ulcères cutanés. Il est également utilisé pour identifier les leucocytes dans l'échantillon de selles (leukogramme fécal).
Dans ce cas, il est intéressant pour le médecin de savoir si la leucocytose présente dans les excréments est par polymorphonucléaire ou mononucléaire. Cette constatation dans le leukogramme fécal guidera s'il s'agit d'une infection bactérienne ou virale, respectivement.
D'un autre côté, les parasites qui circulent dans le sang peuvent être à l'intérieur de l'érythrocyte ou libres dans le plasma. Les parasites recherchés sont Plasmodium spp, trypanosoma cruzii et les filarias, et dans le vétérinaire est utile dans la recherche de Theileery equ et Babesia Caballi, Agents causaux du bébé, en particulier chez les chevaux.
La coloration de Wright, ainsi que celle de Giemsa, permettent de différencier les hémoparasites des composants cellulaires normaux. Pour cela, deux types de ceux étendus peuvent être utilisés:
Fine étendue
Le sang est étendu comme un film mince sur une diapositive. Tachement de Wright, révélant les caractéristiques du noyau et du cytoplasme.
Baisse
Cette méthodologie est utilisée pour étudier la présence de parasites dans une plus grande quantité de sang.
Pour cela, une grande goutte de sang est placée sur une diapositive. Une fois là-bas, vous devez défiler, faire des cercles de plus en plus grands à partir du centre, en utilisant le bord d'une autre diapositive.
Enfin, afin d'observer les parasites dans l'odeur épaisse, les érythrocytes doivent être répertoriés avec de l'eau.
Infections respiratoires
Au niveau respiratoire, cette technique est également utile, car les cellules présentes dans les échantillons d'expectorations, le lavage bronchique ou bronchalvéolaire sont importants pour établir le diagnostic.
Ici, vous pouvez distinguer les cellules polymorphonucléaires et les cellules mononucléaires.
Bactériologie
L'utilisation de cette technique en bactériologie est limitée, car il n'est pas bon de teindre les bactéries. Par conséquent, pour leur coloration, d'autres techniques de coloration spécialisées sont utilisées.
Cependant, il a été utilisé pour rechercher des cellules épithéliales avec des corps d'inclusion Chlamydia trachomatis Dans le frottis de la muqueuse urétrale ou endocervicale, bien qu'il doit être reconnu que ce n'est pas la meilleure méthode.
Il peut vous servir: hémochianinesIl est également possible d'observer, parmi les globules rouges, les bactéries en spirale, comme Borrelia burgdorferi Chez les patients infectés, ainsi que les morulas ou les corps d'inclusion de Ehrlichia SP Dans le cytoplasme des lymphocytes, des monocytes ou des neutrophiles dans un frottis sanguin.
Mycologie
Il Histoplasme capsulatum Il s'agit d'un champignon pathogène fréquemment diagnostiqué par l'observation microscopique de divers échantillons de tissus, teinture avec une coloration Wright.
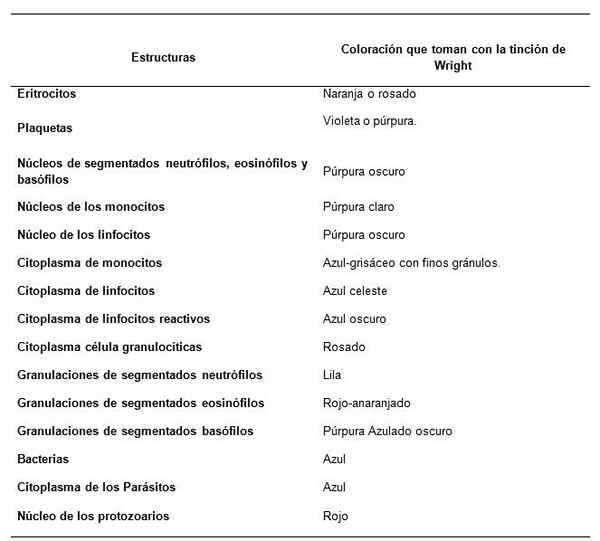
Comment les structures d'échantillons de sang sont-elles observées avec la tache de Wright?
 Recommandations pour le clôture des srols sanguins pour la lecture de l'hémogramme. Source: Retamales E, Mazo V. Institut de santé publique, gouvernement du Chili
Recommandations pour le clôture des srols sanguins pour la lecture de l'hémogramme. Source: Retamales E, Mazo V. Institut de santé publique, gouvernement du Chili Recommandations pour une bonne coloration
- Les extensions des échantillons de sang doivent sécher spontanément. Les frottis doivent être aussi minces que possible pour obtenir une meilleure fixation du colorant et éviter les chevauchements.
- Pour la teinture de haute qualité, il est conseillé. D'un autre côté, l'échantillon idéal est le sang capillaire, sans anticoagulant.
- Cependant, si du sang veineux est utilisé, il doit être utilisé comme anticoagulant EDTA et non héparine, car ce dernier peut déformer les structures cellulaires.
- Pour éviter la détérioration du colorant préparé, il doit être stocké dans des endroits secs.
- Pendant le processus de lavage, l'utilisation de l'eau ajustée au pH neutre est recommandée.
- Il est conseillé de tester les méthodes de teinture utilisées en laboratoire de temps à autre.
Cela se fait des échantillons de coloration ou des modèles étendus, comme contrôle de la qualité. Cette étape est importante, car il est assuré que la coloration est correctement préparée et que les temps de coloration sont bien standardisés.
Si la feuille de motif est mal colorée, il y a des problèmes qui doivent être résolus.
Erreurs communes dans la coloration de Wright
Tache très pâle
Les frottis très pâles sont généralement dus à un très court terme de coloration ou à un lavage très exagéré. Il est corrigé en allongeant le temps de contact avec le colorant ou en diminuant le temps de lavage.
Cloches du colorant
La présence de coloration précipitée dans l'odeur peut avoir plusieurs causes. Les plus fréquents sont: l'utilisation du colorant non filtré, le colorant sur des ponts de coloration inégaux, portez des draps sales avec de la poussière ou de la graisse, ne fais pas un bon lavage lorsque la coloration est terminée.
Frotter avec une coloration extrêmement rougeâtre ou bleue
L'amortisseur est responsable du pH du colorant. Les couleurs avec du pH sous les (acides) indiqués entraîneront l'obtention de odeurs très rouges.
Si le pH du colorant est au-dessus (alcalin) obtiendra un frottis extrêmement bleuâtre.
Mode de stockage
Le réactif doit être stocké à température ambiante.
Les références
- López-jácome, l., Hernández-Durán, m., Colín-Castro, C., Ortega-Peña, S., Cerón-González, G., Franco-cendejas, f. (2014). Coloration de base dans le laboratoire de microbiologie. Recherche sur le handicap.
- Calderón, un., Cardona, J., Vergara, ou. (2013). Fréquence babesia spp. Chez les chevaux de Montería, Córdoba (Colombie). Tour. Udcaactual Disculg. scientifique.
- Rétamales, e., Mazo, V. Institut de santé publique du Chili. Recommandations pour le clôture des srols sanguins pour la lecture de l'hémogramme.

