Talage Giemsa
- 3635
- 603
- Raphaël Charles
 La coloration de Giemsa est une méthode courante pour examiner divers tissus et échantillons de sang
La coloration de Giemsa est une méthode courante pour examiner divers tissus et échantillons de sang Quelle est la tache de Giemsa?
La Talage Giemsa Il s'agit d'un type d'échantillons cliniques (tissus, sang), basé sur le mélange d'acide et de colorants de base. Il a créé Gustav Giemsa, chimiste et bactériologiste allemands, qui ont perfectionné le travail de Romanowsky en ajoutant du glycérol pour stabiliser les composés.
Les modifications générées par la technique Romanowsky originale permis d'améliorer considérablement les observations microscopiques, par conséquent, la technique a été baptisée avec le nom de la coloration de Giemsa.
Étant une technique simple pour effectuer, d'une grande fonctionnabilité et économique, il est actuellement largement utilisé dans le laboratoire clinique pour l'odeur hématologique, les échantillons de moelle osseuse et les coupes de tissus.
La technique de coloration de Giemsa est très utile pour les études cytologiques, car elle permet l'observation de structures cellulaires spécifiques. Cette technique tache les cytoplasmes, les noyaux, les nucléolos, les vacuoles et les granules cellulaires, même en distinguant les traces de chromatine fines.
De plus, des changements significatifs de la taille, de la forme ou de la coloration du noyau peuvent être détectés, où il est possible.
Fondation de la tache de Giemsa
Les colorants de type Romanowsky ont le contraste de base entre les colorants acides et basiques, pour tuer les structures de base et acides, respectivement. Comme on peut le voir, il existe une affinité des colorants acides de la teinture des structures de base et vice versa.
Le colorant de base utilisé est le bleu de méthylène et ses dérivés rouillés (Azure A et Azure B), tandis que le colorant acide est l'éosine.
Les structures acides des cellules sont des acides nucléiques, les granules du segmenté basophile, entre autres. Par conséquent, ils seront teints avec du bleu de méthylène.
Dans ce même sens, les structures de base des cellules sont l'hémoglobine et certains granules, comme le contenu des éosinophiles segmentés, entre autres. Ceux-ci seront tesés avec Eosina.
D'un autre côté, parce que le méthylène et le bleu azur sont caractérisés par des colorants métacromatiques, ils peuvent fournir un ton variable aux différentes structures, selon la charge de polyianions qu'ils possèdent.
C'est ainsi que la combinaison stratégique des colorants basiques et acides parvient à développer un large éventail de couleurs, selon les caractéristiques biochimiques de chaque structure, marchant à travers le bleu pâle, le bleu foncé, le lilas et le bleu violet, dans le cas des structures acides acides.
La coloration fournie par Eosina est plus stable, générant des couleurs entre rougeâtre, orange et saumon.
Matériaux
Préparation de la solution mère
La préparation de la solution mère nécessite de peser 600 mg de poussière de Giemsa, mesurant 500 cc d'alcool metilolique sans acétone et 50 cc de glycérine neutre.
Mode de préparation
Placer la poussière de Giessa lourde sur un mortier. S'il y a des morceaux, ils doivent être pulvérisés. Par la suite, ajoutez une quantité appréciable de la glycérine mesurée et mélangez très bien. Le mélange obtenu est versé dans une bouteille d'ambre très propre.
Le reste de la glycérine est placé dans le mortier. Mélanger à nouveau pour nettoyer le reste du colorant qui a été collé aux murs du mortier et jeter la même bouteille.
Peut vous servir: conidiaLa bouteille est recouverte et prend 2 heures dans un bain-marie à 55 ° C. Aussi long.
Par la suite, le mélange peut refroidir pour placer l'alcool. Auparavant, une partie de l'alcool mesuré est placée dans le mortier pour terminer le lavage de ce qui est colorant, puis est ajouté au mélange, à côté du reste de l'alcool.
Cette préparation doit être autorisée à mûrir pendant au moins 2 semaines. La partie utilisée à partir de la solution mère doit être filtrée.
Pour éviter la contamination de la préparation, il est recommandé de passer la partie qui sera constamment utilisée à une petite bouteille d'ambre avec Dripper. Remercier chaque fois que le réactif est épuisé.
Préparation de la solution de tampon
D'un autre côté, une solution tampon de 7,2 pH est préparée comme suit:
6,77 GR de phosphate de sodium (anhydre) (NAHPO est pesé4), 2,59 gr de phosphate de dihydrogène de potassium (kh2Pote4) et l'eau distillée jusqu'à 1.000 cc.
Préparation de coloration finale
Pour la préparation de la solution de coloration finale, 2 cc de la solution de mère filtrée sont mesurés et mélangés avec 6 cc de la solution tampon. Le mélange est agité.
Un fait pertinent qui doit être pris en compte est que les techniques de préparation du colorant peuvent changer en fonction de la maison commerciale.
Matériaux supplémentaires nécessaires pour effectuer une coloration
En dehors des matériaux décrits, des ponts de coloration, des marches avec de l'eau ou du tampon pour le lavage, les tranches de glissière ou la couverture, un chronomètre, un chronomètre pour contrôler les temps de coloration et du papier de séchage ou un matériau qui sert à sécher (gaze ou coton (gaze ou coton).
Technique
Processus de coloration
1. Avant la coloration, l'échantillon étendu sur une diapositive propre doit être prêt.
Les échantillons peuvent être du sang, de la moelle osseuse, des tissus histologiques ou des échantillons cervicaux-Vaginal. Il est recommandé que les étendus soient bien et aient 1 ou 2 heures de séchage avant de les colorer.
2. Sur un pont de coloration est placé toutes les feuilles qui sont à colorier. Il fonctionne toujours dans le même ordre et chaque feuille est bien identifiée.
3. Placer quelques gouttes de 100% d'alcool métal.
4. Jeter le méthanol présent dans la feuille et laisser sécher dans l'air.
5. Une fois sec, placez la solution de coloration finale avec un compte-gouttes jusqu'à ce qu'il couvre la feuille entière. Laisser acte pendant 15 minutes. Certains auteurs recommandent jusqu'à 25 min. Cela dépend de la maison commerciale.
6. Égoutter le colorant et laver le frottement avec de l'eau distillée ou avec une solution tampon 7.2.
7. Sur un séchage, laissez les feuilles de plein air sécher, disposées verticalement à l'aide d'un support.
Peut vous servir: Renina: structure, production, sécrétion, fonctions8. Nettoyez l'arrière de la diapositive avec de la gaze ou du coton humidifié dans l'alcool pour éliminer tout reste du colorant.
Utilisations / applications de la coloration de Giemsa
La technique de coloration de Giemsa est utilisée dans divers domaines: en hématologie, mycologie, bactériologie, parasitologie, cytologie et cytogénétique.
Hématologie
C'est l'utilisation la plus fréquente qui est donnée à cette coloration. Avec lui, chacune des cellules présentes dans des échantillons de moelle osseuse ou du sang périphérique est identifié. Ainsi que calculer le nombre de chaque série, pouvoir détecter la leucocytose ou la leucopénie, la thrombocytopénie, etc.
Parce qu'il est sensible d'identifier les cellules immatures, elle est pertinente dans le diagnostic de leucémie aiguë ou chronique. Il est également possible de faire le diagnostic d'anémies, comme l'anémie drepanocytaire et falciforme, entre autres.
Mycologie
Dans ce domaine, son utilisation est courante pour la recherche de Histoplasme capsulatum (champignon dimorphe intracellulaire) dans des échantillons de tissus.
Bactériologie
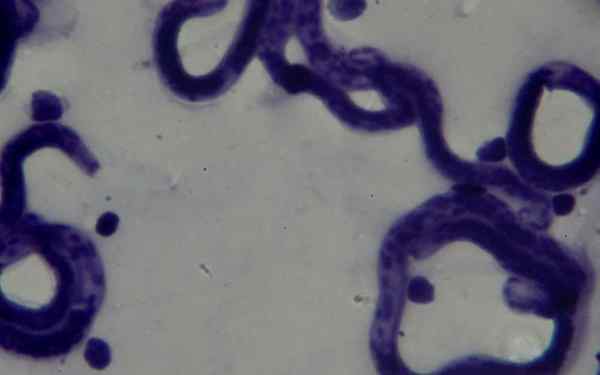
Dans le frottis hématologique teint avec Giemsa, il est possible de détecter Borrelias SP Chez les patients qui étudient la maladie appelée fièvre récurrente. Des spiroquettes sont observées abondantes parmi les érythrocytes, dans des échantillons prélevés dans le pic fiévreux.
Il est également possible de visualiser les bactéries intracellulaires telles que Rickettsias SP et Chlamydia trachomatis Dans les cellules infectées.
parasitologie
Dans le domaine de la parasitologie, la coloration de Giemsa a permis le diagnostic des maladies parasitaires, comme le paludisme, le mal de Chagas et la leishmaniose.
Dans les deux premiers, les parasites Plasmodium sp et le Cruzi Tripaosoma, respectivement, ils peuvent être visualisés dans le sang périphérique des patients infectés. Ils peuvent être trouvés à divers stades selon la phase dans laquelle la maladie est.
Pour améliorer la recherche de parasites sanguins, il est recommandé.
De même, la leishmaniose cutanée peut être diagnostiquée lors de l'évaluation des échantillons de biopsies de cuir teints avec Giemsa, où le parasite est trouvé.
Cytologie
La coloration de Giemsa est également utilisée pour l'étude cytologique des échantillons endocervicaux, bien que ce ne soit pas la technique la plus fréquemment utilisée à cet effet.
Mais en cas de rareté des ressources, il peut être utilisé, ayant une fonctionnabilité similaire à celle offerte par le lac PAP et un coût inférieur. Cependant, cela nécessite une expertise par l'examen.
Cytogénétique
Une caractéristique pertinente de la coloration de Giemsa est sa capacité à rejoindre fortement les régions riches en adénines et timinas d'ADN. Cela permet à l'ADN d'être visualisé pendant la myitose cellulaire, dans différents états de condensation.
Ces études sont nécessaires pour détecter les aberrations chromatiques, telles que les duplications, les suppressions ou les translocations des différentes régions des chromosomes.
 Talage Giemsa. Source: réactifs Panreac Applichem ITW. Version 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espagne.
Talage Giemsa. Source: réactifs Panreac Applichem ITW. Version 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espagne. Recommandations pour une bonne coloration
- Le séchage des draps ne doit pas être accéléré. Le temps prudentiel pour le séchage doit être attendu à l'extérieur. Environ 2 heures.
Peut vous servir: Timina- Coloration immédiatement après 2 heures pour de meilleurs résultats.
- Pour que les odeurs soient mieux fixées et teintes, l'échantillon doit être distribué sur la feuille afin qu'il y ait une couche mince et uniforme.
- L'échantillon de sang préféré est le capillaire, car la smere.
- Si du sang veineux est utilisé, l'EDTA doit être utilisé comme anticoagulant et non l'héparine, car ce dernier déforme généralement les cellules.
Erreurs communes dans la coloration de Giemsa
Dans la pratique de cette coloration, vous pouvez faire des erreurs. Ils sont mis en évidence par des changements soudains dans les tonalités des structures.
Coloration extrêmement bleue
Cela peut être dû à:
- Tradu très épais.
- Dépasser le temps de tachée.
- Laver insuffisamment.
- Utilisation de réactifs bien au-dessus du pH neutre (alcalin).
Dans ces conditions, les couleurs des structures suivantes sont déformées, de telle manière que les érythrocytes, au lieu de teindre le sel de rose, N seront verts, les granules des éosinophiles qui doivent être tesés en brique rouge deviendront bleuâtre ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris ou gris gris, et ainsi de suite y aura une déviation dans les nuances habituelles.
Coloration excessivement rose
Cela peut être dû à:
- Temps de coloration insuffisant.
- Lavage prolongé ou excessif.
- Mal séchage.
- Utilisation de réactifs très acides.
Dans ce cas particulier, les structures qui sont normalement teintes en bleu ne seront pas presque visibles, tandis que les structures teirées comme Rose auront des tons très exagérés.
Exemple: les érythrocytes prendront une forte couleur rouge vif ou orange, la chromatine nucléaire aura l'air rose pâle et les granules éosinophiles seront teints à partir d'un rouge vif vif vif.
Présence de précipités dans le frottis
Les causes peuvent être:
- Utilisez des tranches sales ou mauvaises.
- Ne laissez pas le frottis sécher.
- Laissez la solution de fixation trop longtemps.
- Lavage inadéquat à la fin de la coloration.
- Filtration inadéquate ou non-filtration du colorant utilisé.
Présence d'artefacts morphologiques
Dans les frottis, des artefacts morphologiques peuvent apparaître qui entravent la visualisation et l'interprétation des structures présentes. Ceci est dû à:
- Type d'anticoagulant utilisé, comme l'héparine.
- Utilisation de draps sales, détériorés ou gras.
Mode de stockage
Après préparé, le colorant doit être maintenu à température ambiante (15-25 ° C), pour empêcher le colorant de précipiter. Il doit être stocké dans un conteneur ambre bien fermé.
Les références
- Cannona, D., Brito, E. Et Simons, m. (2016). Évaluation des techniques de coloration pour le diagnostic de la leishmaniose cutanée. Salus.
- Panreac Applichem itw Regins. Talage Giemsa. Version 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espagne.
- Clark, G. Procédures de coloration (1981). Williams & Willkins.

