Coloration à gramme
- 4145
- 527
- Louna Baron
 La coloration à gramme est utile pour visualiser différents types de bactéries
La coloration à gramme est utile pour visualiser différents types de bactéries Qu'est-ce que la tache de Gram?
La Coloration à gramme C'est la technique de coloration la plus simple et la plus utile en microbiologie diagnostique pour identifier les bactéries. Cette technique a été créée par le docteur danois Christian Gram en 1884, qui a classé les bactéries en gram.
La technique a subi certaines modifications de Hucker en 1921 pour stabiliser les réactifs et améliorer la qualité de la coloration, de sorte que la coloration de Gram est également connue sous le nom de Gram-Hucker.
Avec cette technique, c'est aussi possible. Ainsi que sa distribution dans l'espace: en grappe, en chaîne, isolée, par paires, en tétrads, etc.
Base
C'est une technique qui présente 4 étapes fondamentales: tacher, fixer avec le mordant, décoloration et embauche. Par conséquent, en plus des bactéries colorantes, elle vous permet également de les différencier.
Le cristal violet est le premier colorant utilisé. La même chose a une affinité pour le peptidoglycane et se teindrea toutes les bactéries présentes, placés par la suite le lugol, qui agit comme un mordant, c'est-à-dire qu'il induira la formation de complexes insolubles de verre violet / iode / ribonucléaire à l'intérieur de la cellule à l'intérieur de la cellule à l'intérieur de la cellule.
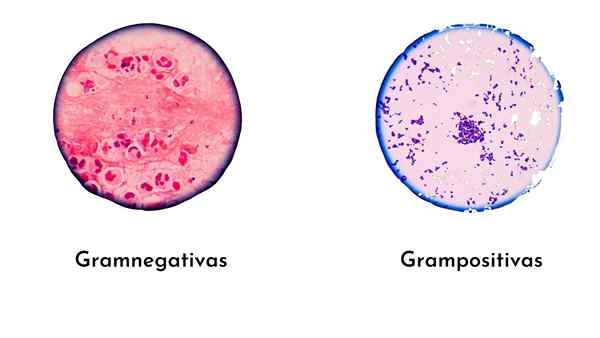
Les bactéries positives à Gram, ayant une épaisse paroi peptidoglycane, se forment plus complexe (verre violet / iode), par conséquent, ils seront teints pourpre.
Il influence également que la paroi des bactéries positives à Gram contienne plus d'acides sans attaquer, qui montrent une grande affinité pour les agents oxydants (Lugol).
Les bactéries négatives à Gram ont une mince cape de peptidoglycane, ce qui rend les bactéries moins complexes que le gramme positif.
Vient par la suite l'étape de la décoloration, où les bactéries à gramme et à gramme ne se comportent pas différemment.
Les bactéries négatives à Gram contiennent une membrane externe riche en lipopolysaccharides qui fait partie de sa paroi cellulaire. Les graisses sont détruites par contact avec de l'alcool d'acétone, de sorte que la membrane externe est déstabilisée, le verre violet libéré.
C'est ainsi qu'il est embauché plus tard avec la safranine de base ou la fuchsin, prenant la couleur rouge.
Dans le cas des bactéries positives à Gram, ils résistent à la décoloration parce que le Javel agit en fermant les pores, ce qui empêche le complexe cristallin / iode violet de pouvoir sortir.
Par conséquent, la coloration avec le verre violet est stable, et il n'y a pas de place pour la safranine ou le fuchsin. Par conséquent, ces bactéries sont teintes intenses ou violettes.
Matériaux
L'ensemble de coloration de Gram est composé de:
- Verre violet.
- Lugol.
- Alcool acétone.
- Safranine de base ou fuchsin.
Préparation des colorants et réactifs
Solution de cristal violet
Solution à:
Crystal violet - 2 gr
95% - 20 cc alcool éthylique
Solution B:
Oxalate d'ammonium - 0.8 GR
Eau distillée - 80 cc
Pour la préparation finale du verre violet, la solution à 1:10 doit être diluée avec de l'eau distillée et mélanger avec 4 parties de la solution b. Le mélange est stocké pendant 24 heures avant de l'utiliser. Il est filtré dans une bouteille de coloration ambre à l'aide d'un filtre en papier.
Il peut vous servir: flore et faune du chiapas: espèces représentativesLe montant utilisé quotidiennement est déplacé vers une bouteille ambrée avec compte-gouttes.
Iode-lugol
Pesez et mesurez la quantité indiquée de chaque composé, comme suit:
Cristaux d'iode - 1 gr
Potassium Ioduro - 2 GR
Eau distillée - 300 cc
L'iodure de potassium est dissous peu à petit dans l'eau et par la suite l'iode est ajouté. La solution à une bouteille ambre est transférée.
Le montant utilisé quotidiennement est déplacé vers une bouteille d'ambre plus petite avec compte-gouttes.
Inconscientes
95% d'alcool éthylique - 50 ml
Acétone - 50 ml
Il est préparé à parts égales. Couvrir bien, car il a tendance à s'évaporer.
Bottero en fut.
Cette préparation fournit une décoloration temporelle modérée de 5 à 10 sec., Et c'est le plus recommandé.
Les débutants préfèrent utiliser seulement 95% d'alcool éthylique, où la décoloration est plus lente, de 10 à 30 s.
Tandis que les plus expérimentés peuvent utiliser de l'acétone pure, où la décoloration se produit très rapidement de 1 à 5 secondes.
Contraste
Solution mère safranine
Safranine - 2.5 GR
À 95% d'alcool éthylique - 100 cc
Après avoir pesé la quantité indiquée de safranine, il se dissout à 100 cc d'alcool éthylique à 95%.
De la solution mère, la solution de safranine de travail est préparée.
Pour ce faire, mesurez 10 cc de la solution mère, ajoutez 90 cc d'eau distillée pour compléter 100 ml.
Il est recommandé de transférer la quantité utilisée quotidiennement dans une bouteille d'ambre avec Dripper.
Micro-organismes qui sont teints faiblement avec la coloration de Gram-Hucker, comme certains anaérobies, Legionella SP, Campylobacter SP et Brucella SP, Ils peuvent être tachés beaucoup mieux si la modification apportée par Kopeloff à la coloration de Gram-Hucker, appelée coloration Gram-Kopeloff faite.
Cette technique modifie le colorant safranine pour la fuchsin de base. Avec cette modification, il est possible de colorer efficacement les micro-organismes susmentionnés.
Stockage de réactifs
Les colorants préparés doivent être stockés à température ambiante.
Préparation de l'échantillon étendu à la coloration
Un échantillon doit contenir au moins 105 Micro-organismes avant son observation est probablement dans un frottis. Les étendus peuvent être effectués à partir de l'échantillon direct ou des cultures dans des supports solides ou liquides.
Les étendus doivent être uniformes, bien distribués et pas très épais, pour une meilleure visualisation des structures présentes.
Gram d'échantillons directs
Gramme d'urine sans centrifugation
L'urine est mélangée et 10 µl est placé sur une lame. L'observation d'au moins un champ de bactérie / immersion indique qu'il y a une infection.
Cela signifie que la récolte aura environ plus de 100.000 UFC / ml (105 UFC / ml) d'urine dans 85% des cas.
Cette méthode n'est pas utile pour les dénombrements coloniaux inférieurs à 100.000 UFC.
Gram de CSF
Le LCR doit être centrifugeuse, le surnageant est retiré et les sédiments s'étendent dans une diapositive. Ce liquide est stérile dans des conditions normales. L'observation des bactéries indique une infection.
Peut vous servir: glandes de selGramme d'échantillons respiratoires
Le lavage des expectorations, bronchique ou broncoalvéolaire, bien qu'il puisse y avoir une variété de micro-organismes, il guidera toujours le diagnostic, en plus d'être utile le type de cellule observée.
Dans le cas d'Esputo, celui étendu avec les parties les plus purulentes de l'échantillon doit être préparée.
Gram
Il n'est pas conseillé de faire du gramme à ce type d'échantillons, car il n'a pas de valeur diagnostique.
Gramme de cultures
Ils peuvent être faits de deux manières, l'un des cultures liquides et une autre des cultures solides.
Cultures liquides
Des cultures liquides, il est extrêmement simple: sous le briquet, plusieurs rôtis du bouillon trouble sont pris et placés sur une diapositive propre et sèche, donnant des mouvements circulaires du centre à la périphérie, pour distribuer uniformément le matériau uniformément.
Il est permis à spontanément d'air. Une fois sec, le matériau est fixé sur la feuille de chaleur. Pour ce faire, à l'aide d'une pince, vous passez la feuille 3 à 4 fois à travers la flamme du briquet Bunsen, en faisant attention de ne pas brûler le matériau.
La feuille est autorisée à refroidir et à placer sur le pont de coloration.
Cultures solides
Pour effectuer une coloration à Gram prolongée à partir d'une culture solide, procédez comme suit:
Avant de choisir les colonies à prendre, vous devez préparer l'agneau à fente, plaçant environ deux gouttes de solution saliologique stérile.
Si la plaque de culture d'origine contient plusieurs types de colonies différentes, une colonie isolée de chacun sera choisie pour effectuer le gramme. Chaque colonie sera prise avec la poignée de platine pour la dissoudre dans la solution saline précédemment placée sur la diapositive.
Des mouvements circulaires sont donnés du centre à la périphérie, pour distribuer de manière homogène la colonie dans la diapositive.
Il est permis à spontanément d'air. Une fois sec, la feuille est fixée avec de la chaleur, comme expliqué ci-dessus (enflammé la fente avec le briquet), en prenant soin de ne pas brûler le matériau.
Cette procédure doit être effectuée avec chaque type de colonie différent. L'ordre de ce qui est observé, par exemple:
Colonia 1: Colonia jaune bétahémolytique: des noix de coco positives ont été observées en grappes.
Colonia 2: Crème Colonia, sans hémolyse: des cocobacilles gramnegatifs ont été observés.
Chaque feuille doit être étiquetée pour savoir ce que nous observons.
Technique
La technique de coloration de Gram est extrêmement simple à effectuer et relativement économique, et ne peut pas manquer dans un laboratoire de microbiologie.
Cela se fait comme suit:
- Réglez le frottis de chaleur et placez sur le pont de coloration.
- La feuille est complètement recouverte de verre violet par 1 minute.
- Laver à l'eau. Ne pas sécher.
- Couvrir la feuille avec une solution de lugol, laisser agir pendant 1 minute. Laver à l'eau. Ne pas sécher.
- Décorer 5 à 10 secondes avec une douce agitation dans l'alcool d'acétone. O Placez la feuille verticalement et déposez des gouttes de décoloration à la surface jusqu'à ce qu'elle traîne la pièce de cristal violet. Ne dépasse pas.
- Laver à l'eau. Ne pas sécher.
- Placer la feuille sur le pont de coloration et couvrir de 30 secondes avec safranine (gram-hucker) ou 1 min avec Fuchsina de base (Gram-Kopeloff).
- Laver à l'eau.
- Laisser échapper spontanément dans l'air en position verticale.
Une fois sec, placez 1 goutte d'huile d'immersion pour l'observer sous la cible de 100x dans le microscope optique.
Utilisations / applications de la coloration à Gram
- Cette technique permet de distinguer les différences morphotiantes de la plupart des bactéries.
- Les levures se distinguent également avec cette coloration. Ils prennent le verre violet, c'est-à-dire qu'ils sont teints en gramme-positif.
- Vous pouvez distinguer les bacilles de spores positives à Gram, où un espace clair est observé dans le bacille où l'endospora s'est formé, bien que les spores ne soient pas bien colorées. Pour teindre les spores, d'autres techniques sont utilisées, comme Shaeffer-Fulton.
- Aide à déterminer le type d'antibiotique qui doit être préparé.
Il convient de noter que cette coloration Ça ne marche pas Pour colorer tous les types de bactéries, c'est-à-dire il y a des cas dans lesquels la coloration ne fonctionne pas.
Dans ces cas, les bactéries qui manquent de paroi cellulaire peuvent être mentionnées. Par exemple: genre Mycoplasme, sphéroplaste, Ureaplasma, L Formes et protoplastes.
De plus, les bactéries avec des bactéries riches en acides mycoliques, telles que les mycobactéries, et les bactéries intracellulaires, comme les chlamydias et les rickettsias.
Il est également inefficace de teindre la plupart des bactéries spirochémales.
Il existe des bactéries du même genre qui peuvent être observées dans le même échantillon que le Gram positif et comme Gram. Lorsque cela se produit, il est appelé la coloration à gramme variable, qui peut être due à une altération des nutriments, de la température, du pH ou de la concentration d'électrolyte.
Erreurs courantes
Décorer exagéré
Exagérer dans le col de décoloration peut provoquer l'observation de micro-organismes négatifs de faux grammes.
N'attendez pas suffisamment de temps de séchage pour ajouter l'huile d'immersion
Cette erreur provoque la formation de micels gras qui entravent l'observation des structures présentes. Cela se produit lorsque l'huile rejoint les molécules d'eau présentes dans l'odeur.
Investissez l'ordre des réactifs
Une erreur comme celle-ci générera des bactéries à gramme à visualiser, c'est-à-dire, false gram-positif.
Utilisez de vieilles cultures (solides ou liquides)
Il peut provoquer des bactéries positives à Gram tacher le gramme-négatif (gramme-false négatif). Cela se produit parce que dans les vieilles cultures, il est probable qu'il existe des bactéries mortes ou détériorées, et dans ces conditions, les bactéries ne conservent pas le verre violet.
Utilisez une très vieille solution de lugol
Au fil du temps, Lugol perd ses propriétés et sa couleur s'estompe. Si le réactif déjà dégénéré est utilisé, cela ne fixera pas bien le verre violet, il est donc possible d'obtenir une visualisation des micro-organismes négatifs à Gram.
Fond bleu
Un arrière-plan correctement décoloré sera rouge. Un fond bleu indique que la décoloration était insuffisante.
Les références
- Maisons-rincón, g. (1994). Mycologie générale. Université centrale du Venezuela.
- Coloration à gramme. Pris.Wikipédia.org.
- González, m., González, n. (2011). Manuel de microbiologie médicale. Direction des médias et des publications de l'Université de Carabobo.

