Systèmes de théorie des collisions, énergie, exemples
- 629
- 118
- Jade Duval
La théorie des collisions Expliquez les vitesses des réactions chimiques dans une perspective moléculaire simplement. Il est donc proche de la cinétique chimique. Au lieu d'approcher les vitesses en termes de concentrations, il le fait en fonction des fréquences de collision.
Lorsque vous parlez de collisions, l'image de certaines balles de billard peut venir à l'esprit s'impactant sur la table. Cependant, les molécules, bien que cette théorie suppose que ses formes sont sphériques, ne se comportent pas de la même manière. Les collisions moléculaires diffèrent de plusieurs manières, à la fois spatiales et énergétiques.

Cette théorie, bien qu'elle puisse être mathématiquement un peu complexe et présente des variations considérables concernant les résultats expérimentaux, offre une image d'interprétations visibles et sans aspects abstraits.
Bien qu'il soit appliqué pour des systèmes gazeux ou des solutions très diluées, ses principes peuvent s'étendre à n'importe quelle réaction et milieu physique.
[TOC]
Conditions pour que les réactions se produisent
Selon la théorie des collisions, il y a trois conditions pour que des réactions se produisent:
- Espèces chimiques (ions, molécules, radicaux, etc.) Ils doivent entrer en collision efficacement.
- Ils doivent transporter suffisamment d'énergie pour la ventilation de leurs liens.
- De plus, l'orientation de l'impact doit être très spécifique.
Collisions moléculaires
 Comme dans le bowling, les réactions ne se produisent que lorsque des collisions efficaces se produisent en termes d'énergie et de conseils
Comme dans le bowling, les réactions ne se produisent que lorsque des collisions efficaces se produisent en termes d'énergie et de conseils Les collisions moléculaires partagent quelque chose en commun avec macroscopique: elles se produisent principalement entre deux espèces ou corps. Deux balles de billard entrent en collision les unes avec les autres, ainsi qu'une balle de football contre un mur, ou deux projectiles au milieu de l'air. C'est-à-dire que les collisions concernant la chimie et ses réactions ont tendance à être de type bimoléculaire.
Peut vous servir: ionisation en physique et chimie: concept, processus et exemplesLes molécules ne sont pas encore, mais elles se déplacent et tournent dans l'espace qui les entoure. Ce faisant, on suppose qu'ils dessinent une sorte de cercle appelé section transversale, sur laquelle il y a la probabilité qu'une autre molécule colison. De même, la théorie considère que les molécules sont sphériques pour simplifier les modèles mathématiques.
Deux molécules, hypothétiquement sphériques, peuvent entrer en collision sans aucun problème, même s'il n'y a pas de réaction chimique. Mais cela n'arrive pas de la même manière en ce qui concerne trois, quatre molécules ou plus.
Plus ils devraient entrer en collision pour obtenir un produit, plus le phénomène devient improbable. Cela s'explique visuellement en essayant que trois balles ou projectiles entrent en collision en même temps ensemble. Par conséquent, les collisions bimoléculaires sont de loin les plus courantes.
Systèmes
La théorie des collisions uniquement est valable pour les systèmes logiciels ou les phases. C'est parce que les gaz montrent un comportement qui peut être bien décrit par leur cinétique.
Pour les phases liquides ou les solutions très diluées, les espèces réactives sont enveloppées dans une cage de molécules de solvant, avec laquelle elles entrent également en collision. Cela modifie le panorama, car les réactions dépendent non seulement des fréquences des collisions, mais aussi de la diffusion des molécules de réactif à travers le milieu.
Énergies de collision
Les molécules peuvent entrer en collision lentement ou très rapidement. Cela dépend de la taille de son énergie, qui à son tour varie considérablement avec la température. Plus la collision est forte, la probabilité qu'il y ait une réaction chimique augmenter, car cette énergie peut briser les liens nécessaires pour en former de nouveaux.
Peut vous servir: monomèresCette énergie est connue sous le nom d'activation, etPOUR, Et c'est caractéristique pour toute réaction chimique. Lorsque la température augmente, la moyenne des molécules est capable de faire correspondre ou de dépasser EPOUR, Ainsi, le nombre de collisions efficaces et, par conséquent, les produits formés, augmentent.
En présence d'un catalyseur etPOUR diminue, car il fournit des surfaces et des moyens électroniques qui bénéficient des collisions. Le résultat: la vitesse de réaction augmente, sans augmenter la température ni ajouter d'autres réactifs.
Facteur stérique
Les espèces chimiques entrent efficacement pour réagir, prédisant cette théorie quelle sera la vitesse de leurs réactions. Cependant, des expériences ont montré que plus les structures des réactifs sont complexes, plus les déviations ou les différences entre les vitesses théoriques et expérimentales.
En effet. C'est là que le facteur stérique entre, ρ, avec lequel il cherche à corriger les vitesses de réaction afin que les prédictions de la théorie avec les résultats expérimentaux soient meilleures.
Exemples de réactions
Réaction bimoléculaire
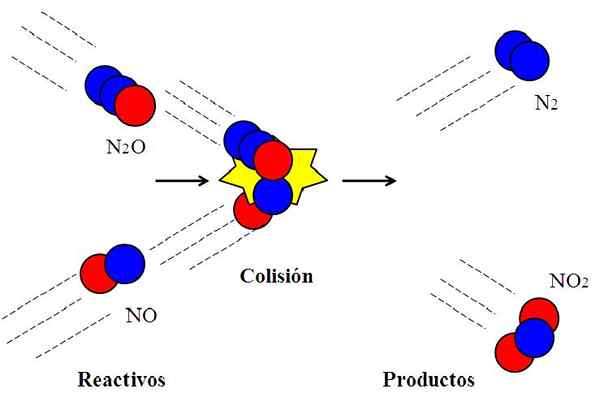 Collision efficace entre les oxydes d'azote. Source: Gabriel Bolívar.
Collision efficace entre les oxydes d'azote. Source: Gabriel Bolívar. La réaction suivante:
N2O + no → n2 + NON2
Il est couramment utilisé pour expliquer ce que signifie l'orientation efficace dans les collisions moléculaires.
La molécule n2Ou, l'oxyde de dyitrogen, il ne réagira pas avec le NO, oxyde nitrique, à moins que pendant la collision l'atome d'oxygène (cercle rouge) du N2Ou choquer directement avec l'atome d'azote (cercle bleu) du NO. Ce n'est que de cette manière que les produits n proviendront2 et non2; Sinon, n molécules2O et ils ne rebondiront pas sans réagir.
Peut vous servir: État gazeux: caractéristiques, loi générale, exemplesCeci est un exemple de collision bimoléculaire pour une réaction bimoléculaire élémentaire. Même lorsque les réactifs ont suffisamment d'énergie pour briser les liens, si l'orientation n'est pas appropriée, il n'y aura pas de réaction chimique.
Réaction unimoléculaire
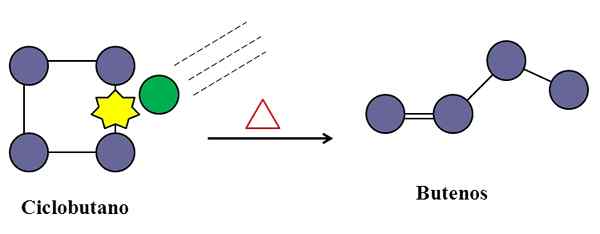 Les collisions sont également indispensables pour l'isomérisation du cyclobutane. Source: Gabriel Bolívar.
Les collisions sont également indispensables pour l'isomérisation du cyclobutane. Source: Gabriel Bolívar. Dans une réaction élémentaire unimoléculaire, les collisions moléculaires peuvent également intervenir, même si ce n'est qu'une espèce qui subit la transformation ou la dégradation de ses liens.
Considérez par exemple l'isomérisation du cyclobutane pour donner naissance à un mélange de butanes. Lorsque la température augmente, les molécules de cyclobutane vibreront à des fréquences plus élevées et entrent en collision avec une plus grande force. Les produits, cependant, montrent que deux molécules de cyclobutane ne réagissent pas les unes aux autres car sinon elles produiraient un composé avec huit carbones.
Au milieu, il peut y avoir des impuretés (Green Circle), qui entrent également en collision avec le cyclobutane, en particulier sur l'un de ses liens C-C. Ceux-ci peuvent être des gaz nobles, ou des molécules très réactives telles que l'azote.
Il arrivera un moment où l'impureté entrera en collision avec une énergie suffisante pour briser l'un des liens C-C du cyclobutane. Et puis, sa molécule cherchera à réorganiser et à créer un butene, reconnaissable pour sa double liaison et sa structure de chaîne linéaire.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Glasstone. (1970). Traité de physicochimie. Aguilar s. POUR. des éditions, Juan Bravo, 38 ans, Madrid (Espagne).
- Walter J. Moore. (1962). Chimie physique. (Quatrième édition). Longmans.
- Wikipédia. (2020). Théorie des collisions. Récupéré de: dans.Wikipédia.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Théorie des collisions. Britannica Encyclopaedia. Récupéré de: Britannica.com
- Clark Jim. (2018). La théorie de la colision des taux de réaction. Récupéré de: Chemguide.co.ROYAUME-UNI
- Lawson P. & Inférieur s. (18 mai 2020). La théorie de la colision. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Caractéristiques du texte didactique, structure, types et exemples
- Amérique insulaire ou pays et caractéristiques Antilles »

