Historique du silicium, propriétés, structure, obtention, utilisations

- 720
- 167
- Prof Ines Gaillard
Il silicium C'est un élément non métallique et en même temps métalloïde qui est représenté par le symbole chimique si. Il s'agit d'un semi-conducteur, qui est une partie essentielle des ordinateurs, des calculatrices, des téléphones portables, des cellules solaires, des diodes, etc.; C'est pratiquement le composant principal qui a permis le règlement de l'ère numérique.
Le silicium a toujours été présent dans le quartz et les silicates, les deux minéraux composant environ 28% en masse de la croûte de la Terre entière. C'est donc le deuxième élément le plus abondant à la surface de la terre, et l'immensité des déserts et des plages offre une perspective de son abondance.
 Les déserts sont une abondante source naturelle de particules de silice ou de granites avec d'autres minéraux. Source: pxhere.
Les déserts sont une abondante source naturelle de particules de silice ou de granites avec d'autres minéraux. Source: pxhere. Le silicium appartient au groupe 14 du tableau périodique, le même que le carbone, situé en dessous. C'est pourquoi cet élément est considéré comme un métalloïde tétravalent; Il a quatre électrons de Valence et en théorie, vous pouvez les perdre tous pour former le cation si4+.
Une propriété qui partage avec le charbon est sa capacité à concaténer; c'est-à-dire que leurs atomes sont liés de manière covalente pour définir les chaînes moléculaires. De même, le silicium peut former ses propres "hydrocarbures", appelés Siltans.
Les composés prédominants du silicium dans la nature sont les célèbres silicates. Dans sa forme pure, il peut se produire comme un solide monocristallin, polyristaline ou amorphe. C'est un solide relativement inerte, il ne représente donc pas des risques considérables.
[TOC]
Histoire
La pierre de silicium
Le silicium est peut-être l'un des éléments qui a eu le plus d'influence sur l'histoire de l'humanité.
Cet élément est le protagoniste de l'âge de pierre, ainsi que de l'ère numérique. Leurs origines remontent à des civilisations avec du quartz et ont fait leur propre verre; Et actuellement, c'est le composant principal des ordinateurs, des ordinateurs portables et des smartphones.
Pratiquement le silicium a été la pierre de deux époques clairement définies dans notre histoire.
Isolement
Lorsque la silice était si abondante, un nom né de la roche de silex, il devait contenir un élément extrêmement riche dans la croûte terrestre; C'était le soupçon réussi d'Antoine Lavoisier, qui en 1787 a échoué dans ses tentatives de la réduire de son oxyde.
Quelque temps plus tard, en 1808, Humphry Davy a fait ses propres tentatives et a attribué son prénom à l'élément: `` Silicium '', ce qui traduit serait comme un «métal péterne» ». C'est-à-dire que le silicium était considéré comme un métal en raison de son manque de caractérisation.
Puis, en 1811, les chimistes français Joseph L. Gay-Lussac et Louis Jacques Thénard ont réussi à préparer le silicium amorphe pour la première fois. Pour cela, ils ont réagi du tétrafluorure de silicium avec du potassium métallique. Cependant, ils n'ont pas purifié ou caractérisé le produit obtenu, ils n'ont donc pas conclu que c'était le nouvel élément de silicium.
Ce n'était rien d'autre que en 1823 lorsque le chimiste suédois Jacob Berzelius a obtenu un silicium amorphe avec une pureté suffisante pour la reconnaître comme du silicium; Nom donné en 1817 par le chimiste écossais Thomas Thomson lors de la considération d'un élément non métallique. Berzelius a effectué la réaction entre le potassium et le fluorosilicate de potassium fondu pour produire ce silicium.
Silicium cristallin
Le silicium cristallin a été préparé pour la première fois en 1854 par le chimiste français Henry Deville. Pour y parvenir, Deville a fait une électrolyse d'un mélange d'aluminium et de chlorures de sodium, obtenant ainsi des cristaux de silicium recouverts d'une couche de siliciuro en aluminium, qui a éliminé (apparemment) les lavant avec de l'eau.
Proprietes physiques et chimiques
Apparence physique
 Le silicium élémentaire, qui a un éclat métallique, mais c'est en fait un métalloïde. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]
Le silicium élémentaire, qui a un éclat métallique, mais c'est en fait un métalloïde. Source: Images haute résolution d'éléments chimiques [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)] Le silicium sous sa forme pure ou élémentaire se compose d'un solide grisâtre ou noir bleuâtre (image supérieure), qui bien qu'il ne s'agisse pas d'un métal, présente des visages lumineux comme s'il était vraiment.
C'est un solide dur mais cassant, qui présente également une surface squameuse si elle est formée par des Polyristales. D'un autre côté, le silicium amorphe ressemble à un solide en poudre brun foncé. Grâce à cela, il est facile d'identifier et de différencier un type de silicium (cristallin ou polyristaline) d'un autre (amorphe).
Masse molaire
28.085 g / mol
Numéro atomique (z)
14 (14Ouais)
Point de fusion
1414 ºC
Point d'ébullition
3265 ºC
Densité
-À température ambiante: 2,33 g / ml
-Juste au point de fusion: 2,57 g / ml
Notez que le silicium liquide est plus dense que le silicium solide; ce qui signifie que leurs cristaux flotteront sur une phase liquide, comme avec le système glaciaire. L'explication est due au fait que l'espace interatomique entre les atomes si dans son verre est plus grand (moins dense), que le correspondant dans le liquide (plus dense).
Chaleur de fusion
50,21 kJ / mol
Chaleur de vaporisation
383 kJ / mol
Capacité thermique molaire
19 789 J / (mol · k)
Électronégativité
1,90 sur l'échelle Pauling
Énergies d'ionisation
-Premièrement: 786,5 kJ / mol
-Deuxième: 1577.1 kJ / mol
-Troisième: 3231,6 kJ / mol
Radio atomique
111 h (mesuré dans leurs cristaux de diamant respectifs)
Conductivité thermique
149 w / (m · k)
Résistivité électrique
2.3 · 103 Ω · m à 20 ºC
Dureté mohs
6.5
Enchaînement
Les atomes de silicium ont la capacité de former des liens Si-Si simples, qui finissent par définir une chaîne (si-si-si ...).
Cette propriété se manifeste également par le carbone et le soufre; Cependant, les hybridations SP3 du silicium est plus déficient par rapport à celui des deux autres éléments et, en outre, leurs orbitales 3p sont plus diffuses, donc le chevauchement des orbitales SP3 résultant est plus faible.
Peut vous servir: réactions exothermiques et endothermiquesLes énergies moyennes des liaisons covalentes Si-Si et C-C sont respectivement de 226 kJ / mol et 356 kJ / mol. Par conséquent, les liens Si-if sont plus faibles. Pour cette raison, le silicium n'est pas la pierre angulaire de la vie (ni le soufre). En fait, la chaîne ou le squelette la plus longue que le silicium peut former est généralement quatre membres (si4).
Nombres d'oxydation
Le silicium peut avoir l'un des nombres d'oxydation suivants, en supposant dans chacun de l'existence des ions avec leurs charges respectives: -4 (oui4-), -3 (oui3-), -2 (oui2-), -1 (oui-), +1 (oui+), +2 (oui2+), +3 (oui3+) et +4 (oui4+). De tous, les -4 et +4 sont les plus importants.
Par exemple, -4 est supposé dans Siliciuros (mg2Oui ou Mg22+Ouais4-)); tandis que +4 correspond à celui de la silice (sio2 ou oui4+SOIT22-).
Réactivité
Le silicium est complètement insoluble dans l'eau, ainsi que de forts acides ou bases. Cependant, il se dissout dans un mélange concentré d'acides nitriques et fluorhorhoriques (HNO3-Hf). De même, il se dissout dans une solution alcaline chaude, la réaction chimique suivante se produisant:
Oui (s) + 2naoh (ac) + h2Ou (l) => na2Sio3(AC) + 2H2(g)
Le métasilicate de sodium, na2Sio3, Il est également formé lorsque le silicium se dissout dans du carbonate de sodium fondu:
Oui (s) + na2CO3(L) => na2Sio3(L) + c (s)
À température ambiante, il ne réagit pas du tout avec de l'oxygène, même pas à 900 ° C, lorsqu'une couche vitreuse protectrice SIIO commence à se former2; Et puis, à 1400 ° C, le silicium réagit avec l'azote d'air pour former un mélange de nitrhures, sans et si3N4.
Le silicium réagit également à des températures élevées avec des métaux pour former des siliciuros métalliques:
2 mg (s) + oui (s) => mg2Oui (s)
2cu (s) + oui (s) => cu2Oui (s)
À température ambiante, il réagit explosif et directement avec les halogènes (il n'y a pas de couche Sio2 qui le protège de cela). Par exemple, vous avez la réaction de formation SIF4:
Oui (s) + 2F2(g) => sif4(g)
Et bien que le silicium soit insoluble dans l'eau, Red Alive réagit avec un courant de vapeur:
Oui (s) + h2Ou (g) => si2(s) + 2h2(g)
Structure et configuration électroniques
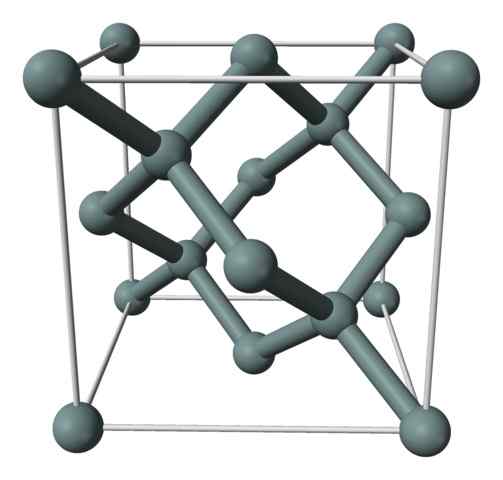 Structure cristalline ou la cellule unitaire du silicium représentée avec un modèle de sphères et de barres. Source: Benjah-Bmm27 [domaine public]
Structure cristalline ou la cellule unitaire du silicium représentée avec un modèle de sphères et de barres. Source: Benjah-Bmm27 [domaine public] L'image supérieure montre la structure cubique centrée sur les faces (FCC), la même que celle du diamant, pour le cristal de silicium. Les sphères grises correspondent aux atomes si, comme apprécié, ils sont liés de manière covalente les uns aux autres; De plus, ils ont des environnements tétraédriques qui se reproduisent le long du verre.
Le cristal de silicium est FCC car un atome est observé s'il est situé sur chacune des faces du cube (6 × 1/2). Il y a aussi huit atomes si dans les sommets du cube (8 × 1/8), et quatre situés à l'intérieur (ceux qui montrent un tétraèdre bien défini autour d'eux, 4 × 1).
Dit ce qui précède, chaque cellule unitaire a un total de huit atomes de silicium (3 + 1 + 4, nombres indiqués dans le paragraphe ci-dessus); Caractéristique qui aide à expliquer sa dureté et sa rigidité élevées, car le silicium pur est un cristal covalent ainsi que du diamant.
Caractère covalent
Ce caractère covalent est dû au fait que, comme le carbone, le silicium a quatre électrons de valence selon sa configuration électronique:
[NE] 3S2 3p2
Pour lier, les orbitales pures 3 et 2p sont inutiles. C'est pourquoi l'atome crée quatre orbitales hybrides SP3, Avec lequel vous pouvez former quatre liaisons covalentes Si-Si et, de cette manière, complétez l'octet de Valence pour les deux atomes de silicium.
Le cristal de silicium est ensuite visualisé comme un réseau covalent et à trois dimensions composé de tétraèdres interconnectés.
Cependant, ce réseau n'est pas parfait, car il présente des défauts et des limites de grains, qui séparent et définissent un cristal d'une autre; Et lorsque de tels cristaux sont très petits et nombreux, il est question d'un solide polyristaline, identifié par sa luminosité hétérogène (similaire à une mosaïque arnaquée ou en argent de surface).
Conductivité électrique
Si-if relie, avec leurs électrons bien situés, en principe en principe en désaccord avec ce qui est attendu d'un métal: une mer d'électrons "mouiller" leurs atomes; Au moins, c'est ainsi à température ambiante.
Lorsque la température augmente, cependant, le silicium commence à conduire l'électricité et, par conséquent, se comporte comme un métal; C'est-à-dire qu'il s'agit d'un élément métalloïde semi-conducteur.
Silicium amorphe
Les tétraèdeurs de silicium n'adoptent pas toujours de modèle structurel, mais peuvent être disposés de manière désordonnée; Et même, avec des atomes de silicium dont les hybridations semblent être SP3 mais sp2, qui contribue à augmenter davantage le degré de désordre. Par conséquent, il est question d'un silicium amorphe et non cristallin.
Dans le silicium amorphe, il y a des postes vacants électroniques, où certains de leurs atomes ont une orbitale avec un électron disparu. Grâce à cela, son solide peut lui-même l'hydrogène, donnant naissance à la formation de silicium amorphe hydrogéral; c'est-à-dire qu'il a des liens si-h avec lesquels les tétraèdres sont complétés dans des positions désordonnées et arbitraires.
Peut vous servir: liens interatomiquesCette section est ensuite conclue en disant que le silicium peut être présenté dans trois types de solides (sans parler de son degré de pureté): cristallin, polyristaline et amorphe.
Chacun d'eux a sa propre méthode ou processus de production, ainsi que ses applications et ses dilemmes lorsqu'ils décident de laquelle des trois à utiliser, connaissant leurs avantages et leurs inconvénients.
Où est-il et obtenez
 Les cristaux de quartz (silice) sont l'un des minéraux principaux et les plus extraordinaires où se trouve le silicium. Source: James St. John (https: // www.Flickr.com / photos / jsjgeology / 22437758830)
Les cristaux de quartz (silice) sont l'un des minéraux principaux et les plus extraordinaires où se trouve le silicium. Source: James St. John (https: // www.Flickr.com / photos / jsjgeology / 22437758830) Le silicium est le septième élément le plus abondant de l'univers, et le second de la croûte terrestre, enrichissant également le manteau de la terre avec sa vaste famille de minéraux. Cet élément est associé extraordinairement bien à l'oxygène, formant une large gamme d'oxydes; Parmi eux, la silice, donc2, et silicates (composition chimique diversifiée).
La silice peut être vue avec l'œil nu dans les déserts et les plages, car le sable est principalement composé de sio2. À son tour, cet oxyde peut se manifester dans quelques polymorphes, étant les plus courants: quartz, améthyste, agate, christobalite, tripoli, coesite, stishovita et thundimita. De plus, il peut être trouvé dans des solides amorphes tels que les opales et les terres de diatomea.
Les silicates, quant à eux, sont encore plus riches structurellement et chimiquement. Parmi certains des silicates que les minéraux peuvent être mentionnés: amiante (blanc, café et bleuâtre), feldspath, argiles, mycies, olive, aluminosilicate, zéolithes, amphibie et pyroxènes.
Pratiquement, toutes les roches sont composées de silicium et d'oxygène, avec leurs liaisons stables Si-O, et leurs silicates et silicates mélangés à des oxydes métalliques et des espèces inorganiques.
-Réduction de la silice
Le problème qui représente l'obtention de silicium est de briser ce lien SI-O, pour lequel des fours spéciaux et une bonne stratégie de réduction sont nécessaires. La matière première de ce processus est la silice en forme de quartz, qui se déplace précédemment jusqu'à ce qu'il soit une poudre fine.
De cette silice moulue, elle peut être préparée soit par du silicium amorphe ou de la polyristaline.
Silicium amorphe
À petite échelle, fabriquée en laboratoire et avec les mesures pertinentes, la silice est mélangée avec de la poussière de magnésium dans un melting-pot et est incinérée en l'absence d'air. La réaction suivante a lieu alors:
Sio2(s) + mg (s) => 2mgo (s) + oui (s)
Le magnésium et l'oxyde sont éliminés avec une solution d'acide chlorhydrique dilué. Ensuite, le solide restant est traité avec de l'acide fluorhorhorique, de sorte qu'il termine la réaction du SiO2 en excès; Sinon, l'excès de magnésium favorise la formation de son siliciuro respectif, mg2Oui, composé indésirable pour le processus.
Le sio2 Il se transforme en gaz volatile SIF4, qui est récupéré pour une autre synthèse chimique. Enfin, la pâte à silicium amorphe est séchée sous un courant d'hydrogène à gaz.
Une autre méthode similaire pour obtenir du silicium amorphe consiste à utiliser le même SF4 Produit précédemment, ou le sicl4 (précédemment acquis). Les vapeurs de ces halogénuros en silicium sont passées sur du sodium liquide dans une atmosphère inerte, de sorte que la réduction du gaz peut être donnée sans la présence d'oxygène:
Sicl4(g) + 4na (l) => oui (s) + 4NACl (l)
Fait intéressant, avec du silicium amorphe, des panneaux solaires à haute performance énergétique sont fabriqués.
Silicium cristallin
À partir de la silice ou du quartz en poudre, ils sont emmenés dans un four à arc électrique, où il réagit avec du coke. De cette façon, l'agent réducteur n'est plus un métal mais un matériau carboné de haute pureté:
Sio2(s) + 2c (s) => oui (s) + 2CO (g)
Dans la réaction, le carbure de silicium est également produit, sic, qui est neutralisé avec un excès de SiO2 (Encore une fois, le quartz est excessivement):
2SIC (S) + SIO2(s) => 3si (s) + 2CO (g)
Une autre méthode pour préparer le silicium cristallin consiste à utiliser l'aluminium comme agent réducteur:
3sio2(s) + 4al (l) => 3si (s) + 2al2SOIT3(S)
Et à partir de l'hexafluorosilicate de potassium, k, k2[Sif6], il est également réagi avec l'aluminium métallique ou le potassium pour provoquer le même produit:
K2[Sif6] (l) + 4al (l) => 3si (s) + 6kf (l) + 4alf3(g)
Immédiatement, le silicium se dissout en aluminium fondu, et lorsque le système se refroidit, le premier cristallise et se sépare de la seconde; c'est-à-dire que les cristaux de silicium se forment, qui ont l'air de couleurs grisâtres.
Silicium polyristaline
Contrairement aux autres synthèses ou productions, pour obtenir du silicium polyristaline, il commence par une phase gazeuse silano, sih4. Ce gaz subit une pyrolyse supérieure à 500 ° C, de telle manière qu'une décomposition thermique se produit et donc, ses vapeurs initiales, elles finissent par déposer des polyristaux de silicium sur une surface de semi-conducteur.
L'équation chimique suivante illustre la réaction qui a lieu:
Oui H4(g) => oui (s) + h2(g)
De toute évidence, il ne devrait pas y avoir d'oxygène dans la chambre, car il réagirait avec le SIH4:
Oui H4(g) + 2e2(g) => sio2(s) + 2h2O (g)
Et la spontanéité de la réaction de combustion est telle, qui se produit rapidement à température ambiante en face.
Une autre voie synthétique pour produire ce type de partie en silicium du silicium cristallin comme matière première. Ils le font réagir avec du chlorure d'hydrogène à une température d'environ 300 ° C, de sorte que le trichlorosilano est formé:
Peut vous servir: fer (élément): caractéristiques, structure chimique, utilisationsOui (s) + 3hcl (g) => sicl3H (g) + h2(g)
Et le sicl3H réagit à 1100 ºC pour régénérer le silicium, mais maintenant Polyristaline:
4sicl3H (g) => oui (s) + 3sicl4(g) + 2h2(g)
Il suffit de voir les équations pour donner une idée du travail et des paramètres de production rigoureux qui doivent être considérés.
Isotopes
Le silicium est naturellement et principalement comme l'isotope 28Oui, avec une abondance de 92,23%.
En plus de cela, il y a deux autres isotopes stables et ne souffrent donc pas de décroissance radioactive: le 29Oui, avec une abondance de 4,67%; et 30Oui, avec une abondance de 3,10%. Être si abondant 28Oui, il n'est pas surprenant que le poids atomique du silicium soit de 28 084 U.
Le silicium peut également être dans plusieurs radio-isolores, parmi lesquels le 31Ouais (t1/2= 2,62 heures) et 32Ouais (t1/2= 153 ans). Les autres (22Ouais - 44S'ils ont t1/2 Très court ou bref (moins de centièmes de secondes).
Des risques
Le silicium pur est une substance relativement inerte, donc elle ne s'accumule généralement dans aucun organe ou tissu tant que l'exposition est faible. En forme de poussière, cela peut provoquer des irritations oculaires, provoquant des déchirures ou des rougeurs, tout en le toucher peut provoquer une gêne cutanée, des démangeaisons et des pelage.
Lorsque l'exposition est très élevée, le silicium peut blesser les poumons; Mais sans effets ultérieurs, à moins que le montant ne soit suffisant pour provoquer une suffocation. Cependant, cela ne se produit pas avec le quartz, qui est associé au cancer du poumon et aux maladies telles que la bronchite et l'emphysème.
De même, le silicium pur est de nature très rare, et ses composés, si abondants dans la croûte terrestre, ne représentent aucun risque pour l'environnement.
Maintenant, en ce qui concerne les organes, ceux-ci pourraient être toxiques; Mais avoir beaucoup d'entre eux dépendent de lequel est pris en considération, ainsi que d'autres facteurs (réactivité, pH, mécanisme d'action, etc.).
Applications
Industrie de construction
Les minéraux en silicium intègrent la "pierre" avec laquelle les bâtiments, les maisons ou les monuments sont construits. Par exemple, les ciments, le béton, le stuc et les briques réfractaires, se composent de mélanges solides basés sur des silicates. De cette approche, on peut apparaître l'utilité que cet élément a dans les villes et l'architecture.
Verre et céramique
De la silice, les cristaux utilisés sur les dispositifs optiques peuvent être fabriqués, que ce soit en tant qu'isolateurs, des cellules pour les échantillons de spectrophotomètres, des cristaux piézoélectriques ou de simples lunettes.
De plus, lorsque le matériau est préparé avec plusieurs additifs, il finit par se transformer en un solide amorphe, bien connu sous le nom de verre; et les montagnes de sable sont généralement la source de silice ou de quartz nécessaire pour sa production. D'un autre côté, avec les matériaux en céramique et en porcelaine des silicates sont fabriqués.
Idées entrelacées, le silicium est également présent dans l'artisanat et les ornementations.
Alliages
Les atomes de silicium peuvent cohérent et être miscibles avec une matrice métallique, il s'agit donc d'un additif pour de nombreux alliages ou métaux; Par exemple, l'acier, pour fabriquer des noyaux magnétiques; Bronzes, pour la fabrication de câbles téléphoniques; et l'aluminium, dans la production d'alliage en aluminium-sailicio pour les pièces automobiles légères.
Par conséquent, non seulement il peut être trouvé dans la "pierre" des bâtiments, mais aussi dans les métaux de leurs colonnes.
Dessiccants
 Boules de silice gélatineuse, utilisées comme dessiccants. Source: Desiccants [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Boules de silice gélatineuse, utilisées comme dessiccants. Source: Desiccants [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] La silice, sous forme de gel ou amorphe, permet de fabriquer des solides qui agissent comme des dessiccants lors de la capture des molécules d'eau qui pénètrent dans le récipient et maintiennent leur intérieur sec.
Industrie électronique
 Le silicium polyristal et amorphe est utilisé pour la fabrication de panneaux solaires. Source: pxhere.
Le silicium polyristal et amorphe est utilisé pour la fabrication de panneaux solaires. Source: pxhere. Les couches de silicium de différentes épaisseurs et couleurs font partie des puces informatiques, ainsi qu'avec leur solide (cristalline ou amorphe), les circuits intégrés et les cellules solaires ont été conçus.
Étant un semi-conducteur, les atomes sont incorporés avec moins (al, b, ga) ou plus d'électrons (p, as, sb) pour le transformer en semi-conducteurs de type p soit n, respectivement. Avec deux syndicats de silicios, un n et l'autre p, Des diodes d'émetteurs de lumière sont fabriquées.
Polymères en silicone
La célèbre colle en silicone se compose d'un polymère organique soutenu par la stabilité des chaînes des liens si-o-si ... si ces chaînes sont très longues, courtes ou réticulées, les propriétés du changement de polymère en silicone, ainsi que leur applications finales.
Parmi ses utilisations, les éléments suivants peuvent être mentionnés ci-dessous:
-Colle ou adhésifs, non seulement pour rejoindre les papiers, mais les blocs de construction, les caoutchoucs, les panneaux de verre, les rochers, etc.
-Lubrifiants dans les systèmes de freinage hydraulique
-Renforce les peintures et améliore la luminosité et l'intensité de leurs couleurs, en même temps qui vous permet de résister aux changements de température sans se fissurer ou cardiquer
-Ils sont utilisés comme répulsifs à eau, qui reste sec certaines surfaces ou objets
-Ils donnent des produits d'hygiène personnelle (pâtes dentaires, shampooing, gels, crèmes de rasoir, etc.) Le sentiment d'être soyeux
-Ses revêtements protègent les composants électroniques des dispositifs délicats de la chaleur et de l'humidité, comme les microprocesseurs
-Avec des polymères en silicone, plusieurs des boules en caoutchouc qui rebondissent sont à peine tombées au sol.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Silicium. Récupéré de: dans.Wikipédia.org
- Microchimiques. (s.F.). Cristallographie du silicium. Récupéré de: microchimiques.com
- Lentech b.V. (2019). Tableau d'époque: Silicon. Récupéré de: lentech.com
- Marques Miguel. (s.F.). Le silicium se produit. Récupéré de: Nautilus.FIS.UC.Pt
- Plus hémorant. (5 novembre 2017). Silicium. Récupéré de: Hemantmore.org.dans
- Pilgaard Michael. (22 août 2018). Silicon: occurrence, isolement et synthèse. Récupéré de: Pilgaardegs.com
- Docteur. Doug Stewart. (2019). Faits d'éléments en silicium. Chimicool. Récupéré de: Chemicool.com
- Christiana Honsberg et Stuart Bowden. (2019). Une collection de ressources pour l'éducateur photovoltaïque. Pveducation. Récupéré de: pveducation.org
- American Chemistry Council, Inc. (2019). Silicones dans la vie quotidienne. Récupéré de: Sehsc.Amérique.com
- « Types de stratégies de distribution et exemples
- Types de stratégie du produit, comment se fait-il et exemple »

