Deuxième droit des formules de thermodynamique, équations, exemples

- 1240
- 358
- Justine Charpentier
La Deuxième loi de la thermodynamique a plusieurs formes d'expression. L'un d'eux indique qu'aucune machine thermique n'est capable de convertir complètement toute l'énergie qu'elle absorbe en travail utilisable (formulation de Kelvin-Planck). Une autre façon de le dire est de dire que les processus réels se produisent dans un tel sens que la qualité de l'énergie est plus faible parce que le Entropie Il a tendance à augmenter.
Cette loi, également connue comme le deuxième principe de la thermodynamique, a été exprimée de différentes manières avec le temps qui passe, du début du 19e siècle à la présente, bien que ses origines datent de la création des premières machines à vapeur en Angleterre, au début du XVIIIe siècle.
 Figure 1. Lors de la construction des blocs de construction au sol, il serait très surprenant de tomber ordonnée. Source: Pixabay.
Figure 1. Lors de la construction des blocs de construction au sol, il serait très surprenant de tomber ordonnée. Source: Pixabay. Mais bien qu'il soit exprimé de plusieurs manières, dans toute l'idée que la matière a tendance à se désordre et qu'aucun processus de 100%, car les pertes existeront toujours.
Tous les systèmes thermodynamiques adhèrent à ce principe, en commençant par l'univers lui-même à la tasse de café du matin qui attend tranquillement sur la table en échangeant de la chaleur avec l'environnement.
Le café se refroidit au fil du temps, jusqu'à ce qu'il soit en équilibre thermique avec l'environnement, il serait donc très surprenant si un jour le contraire se produirait et que l'atmosphère se refroidirait pendant que le café se réchaufferait pour lui-même. Il est peu probable que cela se produise, certains diront cela impossible, mais il suffit de l'imaginer avoir une idée du sens dans lequel les choses se produisent spontanément.
Dans un autre exemple, si nous glissons un livre à la surface d'une table, il finira par s'arrêter, car son énergie cinétique sera perdue sous forme de chaleur due à la friction.
La première et la deuxième loi de la thermodynamique ont été établies vers 1850, grâce à des scientifiques comme Lord Kelvin -Creator du terme "thermodynamique" -, auteur de William-Auteur du premier texte formel de la thermodynamique - et Rudolph Clausius.
[TOC]
Formules et équations
Entropie-moins que le début - nous aide à établir le sens dans lequel les choses se produisent. Revenons à l'exemple des corps en contact thermique.
Lorsque deux objets à des températures différentes sont mis en contact et finalement après un certain temps qu'ils atteignent l'équilibre thermique, ils y sont conduits par le fait que l'entropie atteint son maximum, lorsque la température des deux est la même est la même.
Indiquant l'entropie comme S, Le changement d'entropie ΔS d'un système est donné par:

Le changement d'entropie ΔS Il indique le degré de désordre dans un système, mais il y a une restriction dans l'utilisation de cette équation: elle ne s'applique qu'aux processus réversibles, c'est-à-dire ceux dans lesquels le système peut revenir à son état d'origine sans laisser de marque arrivé-.
Dans les processus irréversibles, la deuxième loi de la thermodynamique se manifeste comme suit:
Peut vous servir: Numéro de Reynolds: à quoi sert-il, comment il est calculé, exerce
Processus réversibles et irréversibles
La tasse de café se refroidit toujours et est un bon exemple de processus irréversible, car il se produit toujours dans une direction. Si de la crème est ajoutée au café et remuer, une combinaison très agréable sera obtenue, mais peu importe la façon dont la remuant, le café et la crème ne seront plus à nouveau, car l'agitation est irréversible.
 Figure 2. La rupture de la tasse est un processus irréversible. Source: Pixabay.
Figure 2. La rupture de la tasse est un processus irréversible. Source: Pixabay. Bien que la plupart des processus quotidiens soient irréversibles, certains sont presque Réversible. La réversibilité est une idéalisation. Pour être effectué, le système doit changer très lentement, de sorte qu'à chaque point, il est toujours en équilibre. De cette façon, il est possible de le retourner à un état précédent sans laisser de marque.
Les processus qui sont assez proches de cet idéal sont plus efficaces, car ils fournissent une plus grande quantité de travail avec moins de consommation d'énergie.
La force de friction est responsable d'une grande partie de l'irréversibilité, car la chaleur générée par elle n'est pas le type d'énergie qui est recherché. Dans le livre qui glisse sur la table, la chaleur par friction est une énergie qui n'est pas récupérée.
Bien que le livre revienne à sa position d'origine, la table aura été chaude comme une empreinte de venir et de l'avoir sur.
Observez maintenant une ampoule à incandescence: la plupart des travaux effectués par le courant qui traverse le filament sont gaspillés en chaleur par joule. Un petit pourcentage est utilisé pour émettre de la lumière. Dans les deux processus (livre et ampoule), l'entropie du système a augmenté.
Applications
Un moteur idéal est celui qui est construit à travers des processus réversibles et qui manque de friction qui provoque des déchets d'énergie, tournant presque Toute l'énergie thermique dans le travail utilisable.
Nous soulignons presque le mot, car même le moteur idéal, qui est Carnot, n'a pas d'efficacité à 100%. La deuxième loi de la thermodynamique n'est pas de cette manière.
Moteur carnot
Le moteur de Carnot est le moteur le plus efficace qui puisse être conçu. Il fonctionne entre deux dépôts de température dans deux processus isothermes - à température constante - et deux processus adiabatiques - sans transfert d'énergie thermique-.
Les graphiques appelés diagrammes de pression PV - Volume - clarifiez la situation:
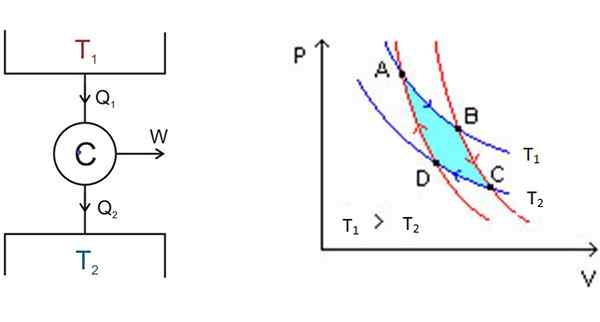 figure 3. À gauche le schéma de moteur Carnot et à droite le diagramme P-V. Source: Wikimedia Commons.
figure 3. À gauche le schéma de moteur Carnot et à droite le diagramme P-V. Source: Wikimedia Commons. À gauche, dans la figure 3 est le schéma du moteur carnot c, qui prend la chaleur q1 du dépôt à la température t1, convertir cette chaleur en travail w et donner des déchets2 au dépôt le plus froid, qui est à la température t2.
À partir de A, le système se dilate jusqu'à ce qu'il atteigne B, absorbant la chaleur à la température fixe t1. En B, le système commence une expansion adiabatique dans laquelle la chaleur n'est pas gagnée ou perdue, pour accéder à C.
En C commence un autre processus isotherme: donner de la chaleur à l'autre dépôt thermique plus froid qui est à t2. Au fur et à mesure que cela se produit, le système est comprimé et le point D est atteint. Il commence un deuxième processus adiabatique pour revenir au point de départ à. De cette façon, un cycle est terminé.
Il peut vous servir: transfert de chaleur par conduite (avec des exemples)L'efficacité de Carnot dépend des températures de Kelvin sur les deux dépôts thermiques:
Efficacité maximale = (qentrée - Qsortie) / Qentrée = 1 - (t2/ T1)
Le théorème de Carnot déclare qu'il s'agit de la machine thermique la plus efficace, mais ne vous dépêchez pas de l'acheter. Vous souvenez-vous de ce que nous avons dit sur la réversibilité des processus? Ils doivent se produire très, très lentement, donc la puissance de sortie de cette machine est pratiquement nulle.
Métabolisme humain
Les êtres humains ont besoin d'énergie pour faire fonctionner tous leurs systèmes, ils se comportent donc comme des machines thermiques qui reçoivent de l'énergie et la transforment en énergie mécanique pour, par exemple, se déplacer.
Efficacité et du corps humain lorsqu'il fait un travail peut être défini comme le rapport entre la puissance mécanique qu'elle peut fournir et l'entrée d'énergie totale, qui vient avec la nourriture.
Comme la puissance moyenne pm C'est le travail fait dans un intervalle de temps Δt, Il peut être exprimé comme:
Pm = W / Δt
Ouais ΔU / ΔT C'est la vitesse à laquelle l'énergie est ajoutée, l'efficacité corporelle reste:

Grâce à de nombreux tests avec des bénévoles, des gains d'efficacité jusqu'à 17% ont été obtenus, offrant environ 100 watts de puissance pendant plusieurs heures.
Bien sûr, cela dépendra en grande partie de la tâche accomplie. La pédalage d'un vélo a une efficacité un peu plus importante, d'environ 19%, tandis que les tâches répétitives qui incluent les lames, les pics et les houes ont une efficacité aussi faible que environ 3%.
Exemples
La deuxième loi de la thermodynamique est implicite dans tous les processus qui se produisent dans l'univers. L'entropie se développe toujours, bien que dans certains systèmes, il semble diminuer. Pour que cela ait augmenté ailleurs, de sorte que dans l'équilibre total, c'est positif.
- Dans l'apprentissage, il y a l'entropie. Il y a des gens qui apprennent bien et vite, en plus de pouvoir s'en souvenir facilement. On dit que ce sont des gens avec un apprentissage à faible entropie, mais ils sont sûrement moins nombreux que ceux d'une entropie élevée: ceux qui se souviennent le plus des choses qu'ils étudient.
- Une entreprise avec des travailleurs désorganisés a plus d'entropie que celle dans laquelle les travailleurs effectuent des tâches de manière ordonnée. Il est clair que ce dernier sera plus efficace que le premier.
- Les forces de friction génèrent moins d'efficacité dans le fonctionnement des machines, car elles augmentent la quantité d'énergie dissipée qui ne peut pas être utilisée efficacement.
- Lancer un dés a une plus grande entropie que de jeter une pièce dans les airs. Après tout, le lancement d'une devise n'a que 2 résultats possibles, tandis que le lancement des dés est de 6. Plus les événements sont probables, plus il existe d'entropie.
Peut vous servir: quels sont les éléments du mouvement?Exercices résolus
Exercice 1
Un cylindre avec un piston est rempli d'un mélange de liquide et de vapeur d'eau à 300 K et 750 kJ de chaleur est transféré à un processus de pression constante. En conséquence, le liquide à l'intérieur du cylindre est vaporisé. Calculez le changement d'entropie dans le processus.
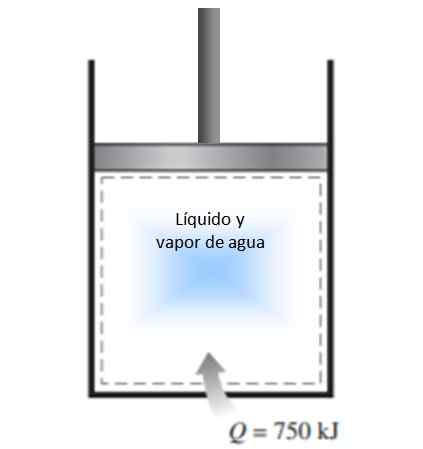 Figure 4. Figure pour l'exemple résolu 1. Source: F. Zapata.
Figure 4. Figure pour l'exemple résolu 1. Source: F. Zapata. Solution
Le processus décrit dans l'énoncé est effectué à une pression constante dans un système fermé, qui ne connaît pas l'échange de masse.
Puisqu'il s'agit de vaporisation, au cours de laquelle la température ne change pas (pendant les changements de phase, la température est constante), la définition du changement d'entropie donné ci-dessus peut être appliquée et la température peut laisser de côté l'intégrale:

ΔS = 750.000 J / 300 K = 2500 J / K.
Puisque le système arrive au système, le changement d'entropie est positif.
Exercice 2
Un gaz subit une augmentation de pression de 2.00 à 6.00 atmosphères (ATM), maintenant un volume constant de 1.00 m3, puis se développez à une pression constante jusqu'à ce qu'il atteigne un volume de 3.00 m3. Enfin retourner à son état initial. Calculez la quantité de travail effectuée en 1 cycle.
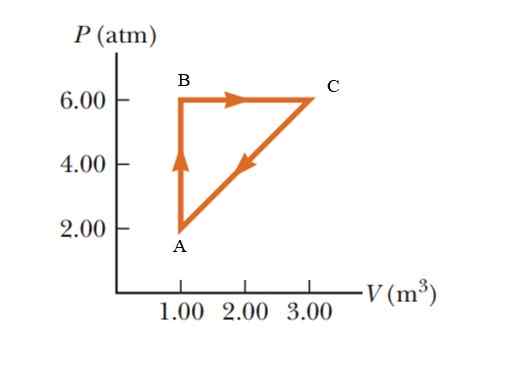 Figure 5. Processus thermodynamique dans un gaz pour l'exemple 2. Source: Serow-Vulle. Fondamentaux de la physique.
Figure 5. Processus thermodynamique dans un gaz pour l'exemple 2. Source: Serow-Vulle. Fondamentaux de la physique. Solution
Il s'agit d'un processus cyclique dans lequel la variation énergétique interne est nulle, selon la première loi de la thermodynamique, donc q = w. Dans un diagramme P -V (pression - volume), le travail effectué pendant un processus cyclique est équivalent à la zone verrouillée par la courbe. Pour donner les résultats du système international, il est nécessaire de changer les unités de la pression à travers le facteur de conversion suivant:
1 atm = 101.325 kPa = 101.325 PA.
La zone enfermée par le graphique correspond à celle d'un triangle dont la base (3 - 1 m3) = 2 m3 et dont la hauteur est (6 - 2 atm) = 4 atm = 405.300 PA
WAbca = ½ (2 m3 x 405300 pa) = 405300 J = 405.3 kJ.
Exercice 3
On dit que l'une des machines les plus efficaces qui ont été construites est une turbine à vapeur alimentée par du charbon sur la rivière Ohio, qui est utilisée pour conduire un générateur électrique fonctionnant entre 1870 et 430 ° C.
Calculer: a) Efficacité théorique maximale, b) la puissance mécanique délivrée par la machine si elle est absorbée 1.40 x 105 J d'énergie chaque seconde du réservoir chaud. On sait qu'une réelle efficacité est de 42.0%.
Solution
a) L'efficacité maximale est calculée avec l'équation donnée ci-dessus:
Efficacité maximale = (qentrée - Q sortie) / Qentrée = 1 - (t2/ T1)
Pour passer le Celsius à Kelvin, il suffit d'ajouter 273.15 à la température Celsius:
Multipliant par 100%, vous avez une efficacité en pourcentage maximale, qui est de 67.2%
c) Si l'efficacité réelle est de 42%, il y a une efficacité maximale de 0.42.
La puissance mécanique délivrée est: p = 0.42 x 1.40 x10 5 J / s = 58800 W.
Les références
- Bauer, w. 2011. Physique pour l'ingénierie et les sciences. Volume 1. Mc Graw Hill.
- Cengel, et. 2012. Thermodynamique. 7mame Édition. McGraw Hill.
- Figueroa, D. (2005). Série: Physique pour la science et l'ingénierie. Volume 4. Fluides et thermodynamique. Édité par Douglas Figueroa (USB).
- Chevalier, r. 2017. Physique pour les scientifiques et l'ingénierie: une approche stratégique.
- López, C. La première loi de la thermodynamique. Récupéré de: Culturacientifica.com.
- SERAY, R. 2011. Fondamentaux de la physique. 9n / A Cengage Learning.
- Université de Séville. Machines thermiques. Récupéré de: Laplace.nous.est
- « Principes, périodes et modèles de la théorie des avocats
- Modifications des types d'État et de leurs caractéristiques (avec des exemples) »


=0.672)