Modifications des types d'État et de leurs caractéristiques (avec des exemples)
- 4120
- 1216
- Jade Duval
Les Modifications de l'État ou la phase sont un phénomène thermodynamique où la matière connaît des changements physiques réversibles. On dit qu'il est thermodynamique car un transfert de chaleur se produit entre la matière et l'environnement; Ou ce qui est la même, il existe des interactions entre la matière et l'énergie qui induisent un réarrangement des particules.
Les particules qui éprouvent le changement de statut restent les mêmes avant et après la même. La pression et la température sont des variables importantes dans la façon dont ceux-ci sont accueillis dans une phase ou une autre. Lorsqu'un changement d'État se produit, un système biphasique est formé, composé de la même question dans deux états physiques différents.
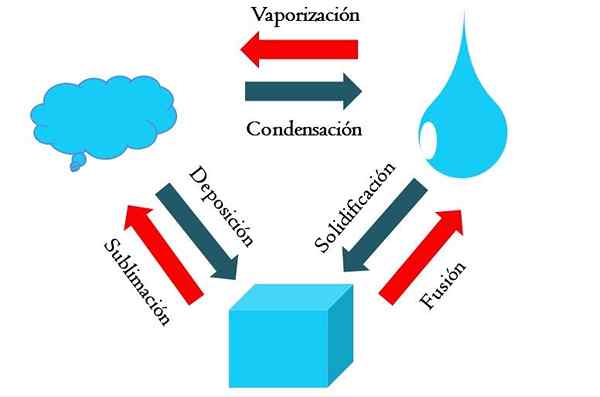
 Modifications de l'État. Source: Gabriel Bolívar
Modifications de l'État. Source: Gabriel Bolívar L'image plus élevée montre les principaux changements d'état que la matière éprouve dans des conditions normales.
Un cube solide d'une substance bleuâtre peut devenir liquide ou gazeux en fonction de la température et de la pression de son environnement. Il représente en soi une seule phase: le solide. Mais, au moment de la fusion, c'est-à-dire une fusion, un équilibre solide-liquide appelé fusion (flèche rouge entre le seau et la goutte bleue est établie).
Pour que la fusion se produise, le cube doit absorber la chaleur de son environnement pour augmenter sa température; Par conséquent, c'est un processus endothermique. Une fois le cube fondu, il est à nouveau une seule phase: celle de l'état liquide.
Ce trota peut continuer à absorber la chaleur, ce qui augmente sa température et donne lieu à la formation de bulles gazeuses. Encore une fois, il y a deux phases: un liquide et l'autre soda. Lorsque tout le liquide s'est évaporé à travers son point d'ébullition, il est alors dit qu'il a bouilli ou vaporisé.
Maintenant, les gouttes bleuâtres ont été transformées en nuages. Jusqu'à présent, tous les processus ont été endothermes. Le gaz bleuâtre peut continuer à absorber la chaleur jusqu'à ce qu'il soit chauffé; Cependant, étant donné les conditions terrestres, celle du contraire a tendance à se refroidir et à se condenser à nouveau dans le liquide (condensation).
D'un autre côté, les nuages peuvent également être déposés directement dans une phase solide, formant à nouveau le cube solide (dépôt). Ces deux derniers processus sont exothermiques (flèches bleues); c'est-à-dire qu'ils libèrent de la chaleur dans l'environnement ou autour.
En plus de la condensation et du dépôt, il y a un changement d'état lorsque le Blota se gèle à de basses températures (solidification).
[TOC]
Types de changements d'État et leurs caractéristiques
L'image montre les changements typiques pour les trois états de matière (les plus courants): solide, liquide et gazeux. Les changements accompagnés des flèches rouges sont endothermiques, ils impliquent une absorption de chaleur; Tandis que ceux accompagnés de flèches bleues sont exothermiques.
Une brève description de chacun de ces modifications sera apportée ci-dessous, mettant en évidence certaines de ses caractéristiques à partir d'un raisonnement moléculaire et thermodynamique.
- La fusion
La fusion est le changement d'état d'une substance de l'état solide vers le liquide.

À l'état solide, les particules (ions, molécules, grappes, etc.) sont des «prisonniers», situés dans des positions fixes d'espace sans pouvoir se déplacer librement. Cependant, ils sont capables de vibrer à différentes fréquences, et si ceux-ci sont très forts, l'ordre rigoureux imposé par les forces intermoléculaires commencera à "s'effondrer.
En conséquence, deux phases sont obtenues: l'une où les particules continuent de limiter (solide), et une autre où elles sont plus libres (liquide), suffisamment pour augmenter les distances qui les séparent les uns des autres. Pour y parvenir, le solide doit absorber la chaleur, et donc ses particules vibreront avec une plus grande force.
Il peut vous servir: masse atomique: définition, types, comment le calculer, exemplesPour cette raison, la fusion est endothermique, et quand il commence, il est dit qu'un équilibre entre les phases solides-liquides se produit.
La chaleur nécessaire pour provoquer ce changement est appelée chaleur ou enthalpie de fusion (ΔHFus). Cela exprime la quantité de chaleur (énergie, dans les unités KJ principalement) qui doit absorber une mole de substance à l'état solide à fondre, et pas simplement augmenter sa température.
Boule de neige
 Faire fondre la neige avec la main. Source: Pixabay
Faire fondre la neige avec la main. Source: Pixabay Dans cet esprit, on comprend pourquoi une boule de neige fond à la main (image supérieure). La neige absorbe la chaleur corporelle, ce qui est suffisant pour augmenter la température de la neige au-dessus de 0 ° C.
Les cristaux de glace présents dans la neige absorbent la bonne chaleur à fondre et pour que leurs molécules d'eau adoptent une structure plus désordonnée. Pendant que la neige fond, l'eau formée n'augmentera pas sa température, car toute la chaleur de la main profite de la neige pour terminer sa fusion.
- Vaporisation

La vaporisation est le changement d'état d'une substance de l'état liquide à la gaze.
Poursuivant avec l'exemple de l'eau, plaçant maintenant une poignée de neige dans un pot et allumant le feu, il est observé que la neige fond rapidement. Lorsque l'eau est chauffée, les petites bulles de dioxyde de carbone et d'autres impuretés de gaz possibles commencent à se former.
 Eau bouillante. Source: Pixabay
Eau bouillante. Source: Pixabay La chaleur a dilaté moléculairement les configurations désordonnées de l'eau, élargissant son volume et augmentant sa pression de vapeur; Par conséquent, il existe plusieurs molécules qui échappent au produit de surface de l'augmentation de l'évaporation.
L'eau liquide augmente lentement sa température, en raison de sa chaleur spécifique élevée (4 184J / ° C ∙ g) g). Il y a un point où la chaleur qui absorbe ne l'utilise plus pour augmenter sa température, mais pour commencer l'équilibre liquide-vapeur; C'est-à-dire qu'il commence à bouillir et tout le liquide passera à l'état gazeux tout en absorbant la chaleur et maintient la température constante.
C'est là que une bulle intense est observée à la surface de l'eau bouillie (image supérieure). La chaleur qui absorbe l'eau liquide de sorte que la pression de vapeur de ses bulles naissantes équivaut à la pression externe, est appelée enthalpie de vaporisation (ΔHVapeur).
Le rôle de la pression
La pression est également décisive dans les changements d'état. Quel est son effet sur la vaporisation? Qu'à une plus grande pression, plus la chaleur qui doit absorber l'eau à bouillir est grande, et par conséquent, il est vaporisé au-dessus de 100 ° C.
En effet.
Les pots de pression utilisent ce fait en leur faveur pour chauffer les aliments dans l'eau à une température au-dessus de leur point d'ébullition.
D'un autre côté, ayant un vide ou une diminution de la pression, l'eau liquide a besoin d'une température plus basse pour bouillir et passer à la phase gazeuse. Avec beaucoup ou peu de pression, au moment de l'ébullition, l'eau doit absorber sa chaleur respective de vaporisation pour terminer son changement d'état.
- Condensation
La condensation est le changement d'état d'une substance de l'état gazeux à l'état liquide.
Peut vous servir: galactose
L'eau s'est vaporisée. Suivant? La vapeur d'eau peut toujours augmenter sa température, devenant un courant dangereux capable de provoquer de graves brûlures.
Cependant, supposons plutôt que ça refroidit. Comme? Libérer de la chaleur à l'environnement, et lorsqu'il est libéré de la chaleur, il est dit qu'un processus exothermique se produit.
En libérant la chaleur, les molécules gazeuses très énergétiques commencent à ralentir. De plus, ses interactions commencent à être plus efficaces à mesure que la température de la vapeur descend. Tout d'abord, les gouttelettes d'eau, les condensats à vapeur, suivis de plus grandes gouttes qui finissent par être attirées par la gravité se formeront.
Pour conder complètement une certaine quantité de vapeur, vous devez libérer la même énergie, mais avec un signe opposé, à ΔHVapeur; c'est-à-dire son enthalpie de condensation ΔHFaire. Ainsi, l'équilibre inverse et vapeur-liquide est stable.
Fenêtres humides
 Condensation de l'eau. Source: Pexels
Condensation de l'eau. Source: Pexels La condensation peut être observée dans les fenêtres ménagères elles-mêmes. Par temps froid, la vapeur d'eau contenue à l'intérieur de la maison entre en collision avec la fenêtre, qui par son matériau a une température plus basse que les autres surfaces.
Là, il est plus facile pour les molécules de vapeur de se regrouper, créant une fine couche blanchâtre facilement amovible à la main. Comme ces molécules libèrent la chaleur (verre chauffant et air), elles commencent à former des grappes plus nombreuses jusqu'à ce qu'elles puissent condenser les premières gouttes (image supérieure).
Lorsque les gouttes augmentent considérablement leur taille, ils glissent par la fenêtre et laissent une traînée d'eau.
- Solidification
La solidification est le changement d'état d'une substance de l'état liquide à l'état solide.

La solidification se produit en raison du refroidissement; En d'autres termes, l'eau gèle. Pour geler, l'eau doit libérer la même quantité de chaleur qui absorbe la glace pour fondre. Encore une fois, cette chaleur est appelée solidification ou enthalpie glaciale, ΔHCongé (-ΔhFus).
Lors du refroidissement, les molécules d'eau perdent de l'énergie et leurs interactions intermoléculaires deviennent plus fortes et plus directionnelles. En conséquence, ils sont commandés grâce à leurs ponts d'hydrogène et forment les cristaux de glace si appelés. Le mécanisme par lequel les cristaux de glace ont un impact sur leur apparence: transparent ou blanc.
 Sculpture de glace. Source: Pixabay
Sculpture de glace. Source: Pixabay Si les cristaux de glace se développent très lentement, ceux-ci n'obluent pas d'impuretés, comme les gaz qui à basse température sont solubilisés dans l'eau. Ainsi, les bulles s'échappent et ne peuvent pas interagir avec la lumière; Et par conséquent, il y a une glace aussi transparente que celle d'une statue de glace extraordinaire (image supérieure).
La même chose qui se produit avec la glace peut se produire avec toute autre substance qui se solidifie en refroidissant. C'est peut-être le changement physique le plus complexe dans les conditions terrestres, car plusieurs polymorphes peuvent être obtenus.
- Sublimation
La sublimation est le changement d'état d'une substance du solide au gaz.

Peut l'eau sublim? Non, du moins pas dans des conditions normales (t = 25 ° C, p = 1 atm). Pour la sublimation, c'est-à-dire le changement de l'état solide au gaz, la pression de vapeur du solide doit être élevée.
De même, il est essentiel que leurs forces intermoléculaires ne soient pas très fortes, de préférence si elles ne consistent que des forces de dispersion
L'exemple le plus emblématique est l'iode solide. C'est un solide cristallin de tons gris-moral, qui a une pression à grande vapeur. Tel est ainsi, que dans son acte, une vapeur violette suit, dont le volume et l'expansion sont notables lorsqu'il est sous le réchauffement.
Peut vous servir: triéthilamine: structure, propriétés, utilisations et risques Sublimation de l'iode. Source: Belkina n v [cc par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)], de Wikimedia Commons
Sublimation de l'iode. Source: Belkina n v [cc par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)], de Wikimedia Commons Dans l'image supérieure, une expérience typique est montrée où l'iode solide s'évapore dans un récipient en verre. Il est intéressant et frappant d'observer comment les vapeurs violettes sont diffusées, et l'étudiant initié peut vérifier l'absence d'iode liquide.
C'est la principale caractéristique de la sublimation: il n'y a pas de présence d'une phase liquide. Il est également endothermique, car le solide absorbe la chaleur pour augmenter la pression de sa vapeur à égaler à la pression extérieure.
- Déposition
 Dépôt de cristal d'iodo. Source: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons
Dépôt de cristal d'iodo. Source: Stanislav.Nevyhosteny [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons Le dépôt est le changement d'état d'une substance de l'état gazeux à l'état solide.
Parallèlement à l'expérience de sublimation de l'iode, vous avez le dépôt que. Le dépôt est le changement ou la transition inverse: la substance passe de l'état gazeux au solide sans la formation d'une phase liquide.
Lorsque les vapeurs violettes d'iode entrent en contact avec une surface froide, ils libèrent de la chaleur pour le chauffer, perdant de l'énergie et regroupent à nouveau leurs molécules dans le solide grisâtre-muddy (image supérieure). C'est alors un processus exothermique.
Le dépôt est largement utilisé pour la synthèse des matériaux où ils dopagent avec des atomes de métal par des techniques sophistiquées. Si la surface est très froide, l'échange de chaleur entre elle et les particules de vapeur est brusque, omettant le passage à travers la phase liquide respective.
La chaleur ou l'enthalpie de dépôt (et non Déposition) est celui de la sublimation (ΔHSous= - ΔHD.E.P). En théorie, de nombreuses substances peuvent être sublimées, mais pour y parvenir, il est nécessaire de manipuler les pressions et les températures, en plus d'avoir son diagramme P VS T à portée de main; dans lequel, leurs phases éloignées possibles peuvent être visualisées.
Autres changements d'État
Bien qu'ils ne soient pas mentionnés, il y a d'autres états de matière. Parfois, ils sont caractérisés par "un peu de chacun", et donc une combinaison d'entre eux. Pour les générer, les pressions et les températures doivent être manipulées à des amplitudes très positives (grandes) ou négatives (petites).
Ainsi, par exemple, si les gaz sont fortement chauffés, ils perdront leurs électrons et leurs noyaux chargés positivement dans cette marée négative constitueront ce qui est connu sous le nom de plasma. Il est synonyme de "gaz électrique", car il présente une conductivité électrique élevée.
D'un autre côté, lorsque les températures descendent trop, la matière peut se comporter sans seis; c'est-à-dire qu'ils présentent des propriétés uniques autour du zéro absolu (0 K).
L'une de ces propriétés est la superfludité et la supraconductivité; ainsi que la formation de condensats de Bose-Einstein, où tous les atomes se comportent comme un.
Même certaines enquêtes indiquent la matière photonique. En eux, les particules de rayonnement électromagnétique, les photons, sont regroupées pour former des molécules photoniques. C'est-à-dire qu'il donnerait de la masse à certains corps de lumière, théoriquement.
Les références
- Helmestine, Anne Marie, Ph.D. (19 novembre 2018). Liste des changements de phase entre l'état de matière. Récupéré de: Thoughtco.com
- Wikipédia. (2019). État de la matière. Récupéré de: dans.Wikipédia.org
- Dorling Kindersley. (2007). État changeant. Récupéré de: factmonster.com
- Meyers ami. (2019). Changement de phase: évaporion, condensation, frezing, fusion, sublimation et dépôt. Étude. Récupéré de: étudier.com
- Bagley M. (11 avril 2016). Matter: Définition et les cinq états de la matière. Récupéré de: LiveScience.com
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- « Deuxième droit des formules de thermodynamique, équations, exemples
- Structure de l'iodure de potassium (KI), propriétés, obtention, utilisations, risques »

