Caractéristiques de la safranine, utilisation, techniques, toxicité
- 2149
- 636
- Adrien Remy
La Safranine Il s'agit d'un colorant mériquinoïde, du nom de la possession de sa structure chimique de 2 anneaux de benzène et de 2 anneaux quinoïdes, ces derniers étant ceux qui fournissent la couleur rouge.
Il est également appelé safranine ou diméthyl rouge basique dans sa forme de résumé, car son nom scientifique est 3,7-diamino-2,8-diméthyl-5-phényl-phényl-phényllvingtH19N4 CL.
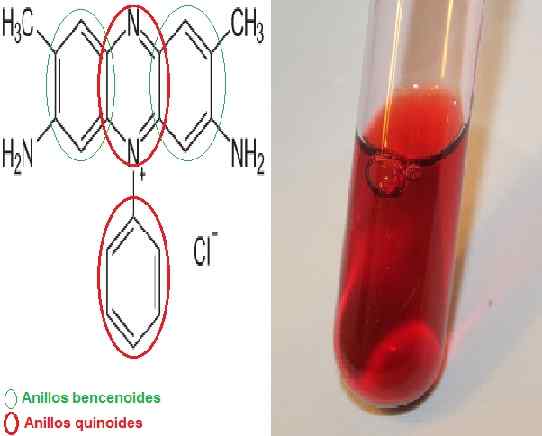
 Structure chimique de la safranine indiquant les anneaux de benzène et de quinoïde / solution aqueuse de safranine. Source: Neurotoger [Domain public] édité par MSC. Marielsa Gil / Lhchem [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Structure chimique de la safranine indiquant les anneaux de benzène et de quinoïde / solution aqueuse de safranine. Source: Neurotoger [Domain public] édité par MSC. Marielsa Gil / Lhchem [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Il existe une variante appelée trimethyle-safranine mais il n'y a pas de différence significative entre les deux substances.
La safranine est un colorant monochromatique et, selon les caractéristiques de la formule chimique, c'est une substance de charge positive. Par conséquent, il a une affinité avec des structures chargées négativement. Ces structures seront teintes en rouge.
Cette propriété donne l'applicabilité dans de nombreuses techniques histologiques pour teindre diverses structures cellulaires, à la fois d'organismes eucaryotes et procaryotes.
La safranine est utilisée comme colorant de contraste dans des techniques d'utilisation de routine importantes et bien connues en bactériologie. Ces techniques sont: la coloration de Gram-Hucker, la coloration Schaeffer Fulton pour les spores ou la coloration des capsules bactériennes, entre autres.
[TOC]
Caractéristiques
La couleur du safran (épices obtenues à partir des stigmates de la fleur de Crocus sativ) était l'inspiration pour placer le nom de cette teinture. Du terme safran vient le nom de la safranine. Cela est dû à la grande similitude entre la couleur du safran et la coloration que cette teinture fournit.
La safranine est obtenue sous forme de cristaux ou de poudre, les deux présentations étant solubles dans l'eau. Le colorant de la safranine n'a pas d'odeur. Tacher les structures rouges. Les structures qui attirent le colorant safranine sont appelées safranophiles.
Structurellement, la safranine est complexe, elle a deux anneaux de benzène aux extrémités et au centre, les deux anneaux quinoïdes se trouvent là où se trouve le cation n+. Le centre de la structure est le système chargé de fournir de la couleur. Par cette caractéristique, ce colorant est classé dans la catégorie II.
Utiliser
La safranine est utilisée pour teindre diverses structures. Souligne particulièrement les cellules de Kulchitsky présentes dans le tractus gastro-intestinal, également appelées cellules enterocromofines.
Il est capable de teindre les micro-organismes appartenant à la famille Rickettsiaceae. De même, il est utilisé dans diverses techniques, comme la méthode de Koster, une méthode modifiée utilisée pour la coloration des bactéries de genre Brucella.
D'un autre côté, la safranine est utilisée dans la technique de coloration des spores Schaeffer Fulton et dans la coloration de Gram-Hucker. Dans les deux techniques, la safranine travaille comme un colorant de contraste.
Peut vous servir: indienDans le premier, les spores prennent la couleur du vert de la malachite et le reste des structures est rouge par la safranine. Dans la seconde, les bactéries Gram négatives perdent la couleur du verre violet dans l'étape de décoloration, donc la safranine est celle qui tache les bactéries à Gram négatif de rouge.
De plus, la safranine est utilisée en bactériologie pour préparer une gélose Brucella avec une dilution de safranine 1: 5000. Ce milieu sert à différencier l'espèce Brucella Suis du reste de l'espèce. Brucella melitensis et Brucella abortus grandir dans ce milieu mais B. Suisse Il est inhibé.
Dans le champ agroindustriel, la safranine a été utilisée à 2,25% et diluée 1:10 pour teindre les échantillons de tige de la plante de canne à sucre.
Cette plante est généralement affectée par les bactéries Leifsonia Xyli Sous-marins. Xyli, qui endommage le xilema de la plante. Les tiges teintes sont évaluées pour déterminer la fonction des vaisseaux xylem.
Techniques dans le domaine de la bactériologie
Castañeda Tachette pour la tache RIckettssias
Un frottis sanguin ou tissulaire est placé dans une solution tampon (phosphate amortissement pH 7,6). Il est autorisé à sécher spontanément puis recouvert de bleu de méthylène pendant 3 minutes et a contracté avec safranine. Rickettsas colored bleu, contrastant avec l'arrière-plan rouge.
Coloration de Koster modifiée pour Brucella
Un frottis est effectué et Flamea dans le briquet pour la fixation. Par la suite, il est recouvert d'un mélange de 2 parties de safranine aqueuse saturée avec 3 parties de solution KOH 1 mol / L, pendant 1 minute. Un lavage avec de l'eau distillée est effectué et 1% de fenado méthylène bleu.
Si l'échantillon contient des bactéries de genre Brucella Ceux-ci seront observés orange dans un fond bleu.
Capsules bactériennes
Un mélange de suspension bactérienne avec de l'encre chinoise est effectué et la safranine est ajoutée. Un halo rougeâtre sera observé au microscope autour de chaque capsule bactérienne avec un fond noir.
Peut vous servir: substances puresTachement des spores Schaeffer Fulton
Une étendue avec la suspension bactérienne est effectuée. Ensuite, il est fixé pour chauffer. Il est recouvert de 5% de malachite vert, fréquemment flamboyant jusqu'à l'émission de vapeurs. Le processus est répété pendant 6 à 10 minutes. Enfin, il est lavé à l'eau et embauché avec 0,5% de safranine pendant 30 secondes. Les bacilles sont teints en rouge et les spores vertes.
Tache de peluche à Gram
Une suspension bactérienne étendue est effectuée et fixée pour chauffer. La lame avec du verre violet de 1 minute est couverte. Alors le lugol est placé comme une solution mordante par 1 minute. Par la suite, il est décoloré avec de l'alcool d'acétone et finalement embauché avec safranine pendant 30 secondes.
Les bactéries à Gram positif sont teintes de violet bleu et de bactéries à Gram négatif.
Certains laboratoires ont cessé d'utiliser la technique Gram-Hucker pour adopter la technique de Gram-Kopeloff modifiée. Dans ce dernier, la safranine est remplacée par du fuchsin de base. C'est parce que safranine tache faiblement les espèces de genres Legionella, Campylobacter et Brucella.
Techniques dans le domaine de l'histologie
Kulchitsky Cell Tideing (enterocromofines)
Les coupes de tissus du tractus gastro-intestinal avec du chlorure d'argent sont teintes. Ensuite, il est décoloré avec du thiosulfate de sodium et finalement embauché avec safranine.
Les cellules Kulchitsky se distinguent car elles sont présentées avec des granules bruns noirâtres.
Coloration pour la détection de l'arthrose
Safranine car il a une charge positive, des groupes carboxy et sulfate de glycosaminoglycanes se lient très bien. Ceux-ci font partie des protéoglycanes qui constituent le cartilage articulaire. En ce sens, lors de la teinture avec de la safranine ou, on peut identifier s'il y a ou non une perte de cartilage.
La perte de tissu cartilagineux peut être mesurée à l'échelle de Mankin ou également appelée échelle d'arthrose.
La technique est ensuite expliquée: la coupe histologique est immergée dans un plateau avec une solution d'hématoxyline ferrique de Weigert, puis elle est passée à l'alcool acide et lavée à l'eau.
Continuez le processus de coloration en immergeant la feuille en vert rapide, lave avec de l'acide acétique et submerge maintenant dans la safranine ou. Pour terminer le processus, il est déshydraté à l'aide d'alcools à différentes concentrations dans l'ordre croissant. La dernière étape nécessite Xileno ou Xilol pour que l'échantillon soit clarifié.
Peut vous servir: métalloïdesLes draps sont conditionnés par le baume canadien ou similaires à être observés au microscope.
Avec cette technique, les noyaux sont teints en noir, l'os vert et le cartilage où se trouvent les protéoglycanes rouges.
Tincion pour l'identification des macroalgas
Pérez et al en 2003 ont proposé une technique simple et économique pour teindre les macroalgas. Les échantillons sont préparés dans des coupes histologiques avec de la paraffine. Les coupes sont fixées avec 1% de glycérine, se laissant complètement sec. Ensuite, il est placé dans du xylol pour éliminer la paraffine.
La coupe est réhydratée, ce qui le fait passer à travers une série de plateaux qui contiennent de l'éthanol à différents degrés de concentration (ordre décroissant), pendant 2 min dans chacun.
Par la suite, il est teint pendant 5 minutes avec un mélange 3: 1 de safranine à 1% avec 1% de bleu de toluidine, tous deux préparés avec 50% d'éthanol. Le mélange est ajouté trois gouttes d'acide picrique qui agit comme un mordant.
Ensuite, il redevient déshydraté à travers les plateaux d'alcool, mais cette fois en montant. Enfin, il est clarifié avec le xilol et l'échantillon est préparé avec le baume canadien à observer.
Toxicité
Heureusement, la safranine est une teinture qui ne représente pas un danger pour ceux qui le manipulent. C'est un colorant inoffensif, il n'est pas cancérigène et n'est pas inflammable non plus.
En contact direct avec la peau ou les muqueuses peut provoquer une légère rougeur de la zone, sans complications majeures. Pour cela, il est recommandé de laver la zone affectée avec beaucoup d'eau.
Les références
- Garcia H. Colorant safranine ou. Technique de santé, 2012; 1 (2): 83-85. Disponible sur: Médigraphique.com
- Gil m. Coloration à Gram: fondation, matériaux, technique et utilisations. 2019. Disponible sur: Lofede.com
- Gil m. Talage des spores: fondation, techniques et utilisations. 2019. Disponible sur: Lofede.com
- Safranine." Wikipedia, encyclopédie gratuite. 7 mars 2017, 10:39 UTC. Il y a 2019, 20:49 est.Wikipédia.org
- Pérez-Cortéz S, Vera B, Sánchez C. Technique de coloration utile dans l'interprétation anatomique de Graciliase tenuifrons et Gracilaria chilensis (Rhodophyta). Acte de bot. Venez. 2003; 26 (2): 237-244. Disponible sur: SCIELO.org.
- Aleika Church, Peralta Esther Lilia, Alvarez Elba, Milián J, Matos Madyu. Rapport des fonctionnalités des vaisseaux xylèmes et la présence de Leifsonia xyli subp. Xyli. Tour. Protection des légumes. 2007; 22 (1): 65-65. Disponible sur: SCIELO.SLD

