Règle de l'octet

- 858
- 227
- Prof Ines Gaillard
 Représentation d'une molécule de dioxyde de carbone montrant la conformité à la règle des octets
Représentation d'une molécule de dioxyde de carbone montrant la conformité à la règle des octets Quelle est la règle des octets?
La Règle de l'octet C'est une règle pratique qui explique la formation de la liaison chimique des éléments représentatifs basés sur la configuration électronique de sa couche de valence.
Selon cette règle, les atomes se combinent entre eux de manière à ce que chaque atome soit entouré de huit électrons dans sa couche de valence (d'où le mot octet)).
Cette règle a été publiée simultanément dans 1.916 Gilbert Lewis et Walther Kossel. Il reflète l'observation que les gaz nobles sont très stables et tout, à l'exception de l'hélium, ils sont caractérisés par leur couche de valence avec 8 électrons.
La théorie établit que les atomes partagent ou échangent des électrons en formant des liaisons chimiques, afin d'acquérir cette configuration électronique complète.
La règle d'octet et les structures de Lewis
La règle d'octet et les structures Lewis sont étroitement liées. En effet.
En ce sens, l'une des étapes essentielles pour dessiner une structure Lewis, après avoir placé des liens simples entre tous les atomes qui forment la molécule, est de distribuer les électrons de valence restants parmi les atomes les plus électronégatifs pour compléter leurs octets.
Dans les cas où les octets sont sans remplissage, des liaisons doubles ou triples sont formées, toujours à la recherche de la règle des octets pour autant d'atomes que possible. Cette règle empirique est donc essentielle pour la construction de structures Lewis.
Il peut vous servir: Silver Yoduro (AGI): structure, propriétés, obtention, utilisationsExemples de conformité avec la règle des octets
La règle des octets est principalement appliquée aux éléments représentatifs, c'est-à-dire à ceux des blocs S et P du tableau périodique. Cette règle est systématiquement appliquée aux composés contenant du carbone, de l'azote, de l'oxygène et des halogènes, et à quelques exceptions aux autres éléments du bloc P. Cependant, la plupart des métaux de transition ne sont pas conformes.
Quelques exemples de composés dans lesquels la règle des octets est respectée pour tous les atomes sont:
Dioxyde de carbone (CO2)
Comme on peut le voir dans la structure Lewis du dioxyde de carbone présenté ci-dessous, le carbone central et les deux atomes d'oxygène sont conformes à la règle des octets.
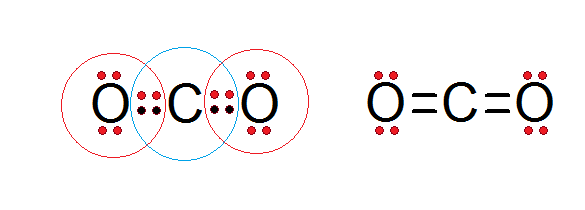
Le carbone est entouré de ses 4 électrons de valence, plus deux électrons de chaque oxygène, qui contribuent à former les doubles liaisons C = O, tandis que chaque oxygène est entouré de 6 électrons propres plus une paire de carbone.
Néopentano (c5H12)
Dans la grande majorité des composés organiques, tous les atomes remplissent la règle des octets (à l'exception de l'hydrogène entouré de seulement 2 électrons). Cela comprend des alcanes tels que Neopentano ou 2.2-diméthylpropane:
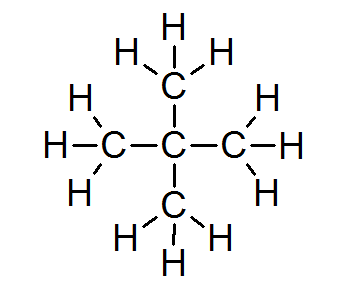
Dans ce cas, on peut également voir que chaque atome de carbone partage ses quatre électrons avec 4 atomes voisins, chacun fournit l'un de ses électrons pour former les 4 liaisons covalentes simples qui se maintiennent.
Pour cette raison, chaque atome de carbone est entouré de 8 électrons de valence, conformes à la règle des octets.
Peut vous servir: énergie d'activationMonoxyde de carbone (CO)
Le monoxyde de carbone est un autre composé moléculaire dans lequel l'oxygène et le carbone partagent des électrons formant une liaison covalente pour satisfaire la règle des octets.
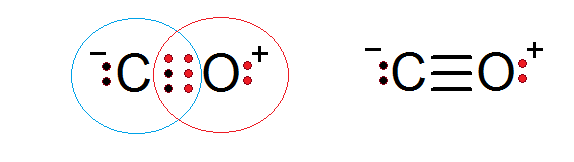
Dans ce cas, le carbone fournit deux électrons et l'oxygène 4 pour compléter les 6 électrons nécessaires pour former la triple liaison covalente qui les unit. Chacun des deux atomes a un électrons supplémentaire sans partager qui complète chaque octet.
Anion nitrate (non3-)
Également dans le cas des ions, la règle des octets est respectée. L'ion nitrate a un atome d'azote central entouré de 3 atomes d'oxygène.
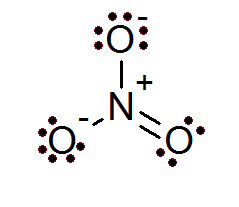
Comme on peut le voir dans ce cas, tous les atomes ont leur octet complet, deux de l'oxygène ont une charge formelle négative tandis que l'azote a une charge formelle positive, ce qui entraîne une charge nette de -1 ion nitrate.
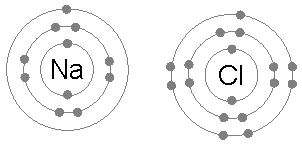
Chlorure de sodium (NaCl)
L'échange d'électrons pour former des composés ioniques est également un exemple courant de l'application de la règle des octets.
Lorsque le chlorure de sodium est formé à partir du chlore et du sodium, il commence à partir de deux atomes qui ne sont pas conformes à la règle des octets, car le sodium sur un électron et le chlore manque pour compléter son octet.
Ensuite, le sodium donne son électron au chlore, laissant le cation entouré de 8 électrons et en terminant à son tour l'octet vers le chlore en formant l'ion chlorure.
 Exceptions à la règle des octets
Exceptions à la règle des octets
Tout comme il existe un grand nombre de composés dans lesquels tous les atomes respectent la règle des octets, il existe également plusieurs exemples d'atomes qui ne sont pas conformes.
Il peut vous servir: potentiel z: valeurs, degrés de coagulation, détermination, utilisationsCertains sont entourés de moins de 8 électrons, donc ils sont Pauvres espèces d'électrons, tandis que d'autres sont entourés de plus de huit électrons, auquel cas il est dit qu'il a un octet élargi ou est appelé Atome hypervalent.
Exemples d'espèces d'électrons pauvres
Bordean (BH3)
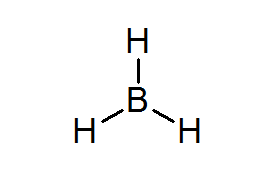
Ce composé est un exemple typique d'un mauvais type d'électrons. Ni le bore ni les hydrogènes environnants n'ont suffisamment d'électrons pour satisfaire la règle des octets dans l'atome central. Cela amène le bore à recevoir quelques électrons d'un autre atome dans une autre molécule, transformant le bordeal en acide de Lewis.
Triclurur en aluminium (alcl3)
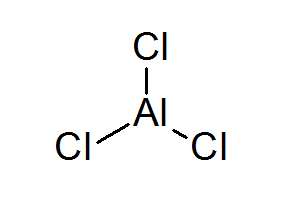
L'alcl3 C'est un autre exemple d'acide Lewis qui doit son comportement chimique auquel il ne respecte pas la règle des octets.
Exemples d'espèces hypervaliennes
Hexafluoruro du soufre (SF6)
Un exemple typique d'un octet élargi est le SF6, qui est généralement représenté comme un soufre central avec 6 liaisons covalentes simples avec des atomes de fluor. Dans ce cas, le soufre est entouré de 12 électrons de valence au lieu de 8, donc il viole la règle des octets.
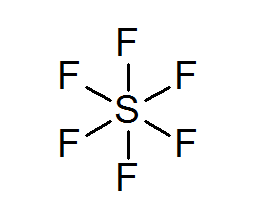
Malgré cela, des modèles ont été proposés dans lesquels le soufre est réellement lié à des liaisons covalentes à 4 fluors en même temps, tandis qu'avec les deux autres, forment des liaisons ioniques. Si c'est le cas, il respecterait la règle des octets.
Phosphore pentachlorure (PCL5)
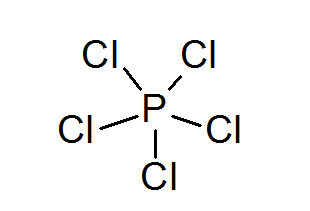
Comme dans le cas du soufre, le phosphore peut également former des composés avec des octets étendus, dans ce cas entourés de 10 électrons.

