Principe AUFBAU
- 3090
- 259
- Raphaël Meyer
 Ordbitals de remplissage des orbitales atomiques selon le principe d'Aufbau
Ordbitals de remplissage des orbitales atomiques selon le principe d'Aufbau Quel est le principe Aufbau?
Il Principe AUFBAU, Également connu sous le nom de règle pluviale ou de principe de construction, c'est une règle pratique qui permet de prédire la configuration électronique de la grande majorité des éléments du tableau périodique, ainsi que celui de ses ions.
Ce principe établit que, comme des protons sont ajoutés au noyau, un par un pour construire successivement chaque élément chimique, les électrons sont également ajoutés successivement aux moins orbitales atomiques d'énergie disponibles.
En d'autres termes, Aufbau a établi qu'il existe un ordre spécifique selon lequel les orbitales atomiques peuvent être remplies. Cette commande est expliquée ci-dessous.
L'ordre de remplissage des orbitales selon le principe d'Aufbau
L'ordre dans lequel les orbitales atomiques sont remplies dépend de leur niveau d'énergie. La règle d'or est que ces niveaux d'énergie sont remplis du moins au plus grand, comme s'il s'agissait d'un bâtiment dans lequel les appartements doivent être remplis dans les étages les plus bas pour accéder aux étages les plus élevés.
En ce sens, afin de prédire l'ordre de remplissage des orbitales, nous devons d'abord savoir comment ils sont ordonnés en fonction de leur niveau d'énergie. Dans l'analogie du bâtiment, cela signifie savoir quels appartements (orbitaux) il y a à chaque étage.
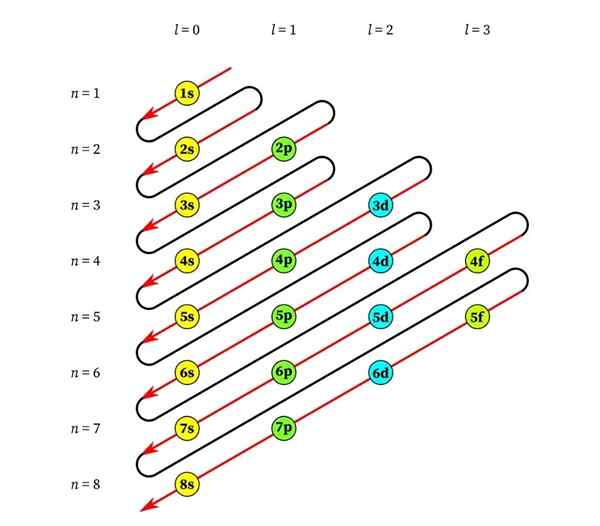
Le graphique suivant montre les niveaux d'énergie des premières orbitales atomiques commandées de la plus basse à une énergie plus faible.
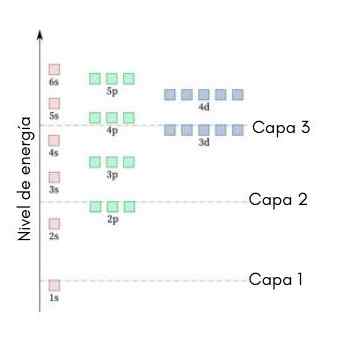
Dans cette image, chaque image représente une orbitale particulière dans laquelle seuls 2 électrons s'adaptent. Chaque groupe de peintures de la même couleur représente un sous-niveau d'énergie.
Ces sous-niveaux sont identifiés par un nombre et une lettre (1s, 3p, 3d, etc.). Le nombre indique le principal niveau d'énergie, tandis que la lettre indique le type d'orbital qui forme le groupe.
Il peut vous servir: chlorure d'aluminium (ALCL3)Selon ce schéma, le premier sous-niveau qui doit être rempli est le 1s (la moindre énergie de tous), puis vient, le 2S, le 2P, les 3S, le 3P, les 4S, la 3D et ainsi de suite.
La règle de la pluie
Malgré la facilité avec laquelle il est facile d'établir l'ordre de remplissage si vous avez un graphique comme le précédent, il est difficile de se souvenir de l'ordre particulier dans lequel les différents sous-niveaux vont. Pour cela, ce que certains appellent "la règle de la pluie" est utilisée.
Cette règle se compose de deux étapes simples:
Étape 1
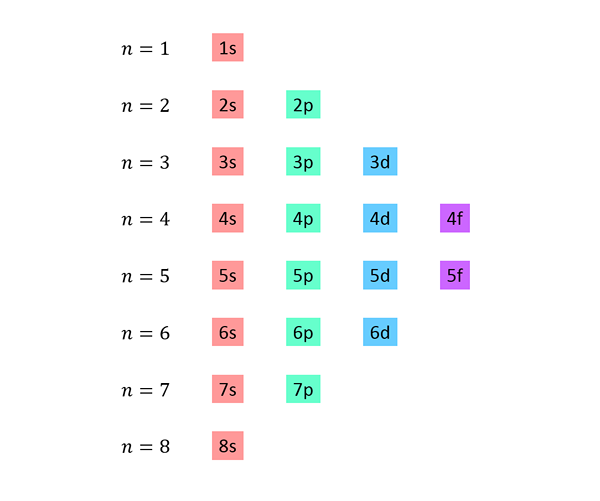
Une liste est faite dans laquelle chaque ligne correspond à un niveau d'énergie, et en contient l'une après l'autre, tous les sous-niveaux disponibles à ce niveau d'énergie.
Par exemple, la première ligne correspond au niveau 1 (n = 1) et ne contient que le sous-niveau 1S; La deuxième ligne correspond au niveau n = 2 et contient des sous-niveaux 2s et 2p; Le troisième contient les sous-niveaux 3S, 3P et 3D, et ainsi de suite.
La liste complète ressemble à ceci:
Étape 2
Les diagonales descendant sont dessinées de droite à gauche, l'une en dessous de l'autre, comme indiqué ci-dessous.
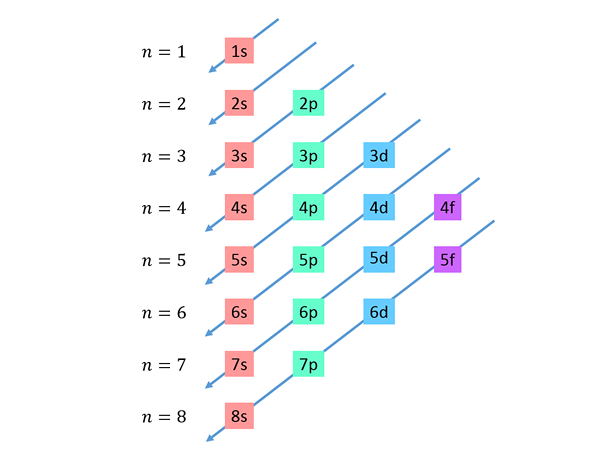
Ces lignes ressemblent à la voie des gouttes d'eau pendant un vent avec vent, donc ce graphique est généralement appelé "la méthode de la pluie". L'ordre de remplissage est déterminé par l'ordre dans lequel ces diagonales touchent les sous-niveaux dans la liste.
Sur la base du chiffre précédent, l'ordre d'énergie des orbitales et, par conséquent, l'ordre dans lequel ils doivent être remplis est:
Peut vous servir: table quantique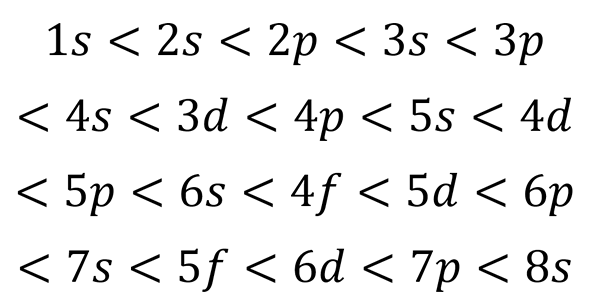
Cette commande de remplissage est la seule qui compte vraiment lors de l'écriture de la configuration électronique d'un atome. Lorsque vous remplissez ces sous-niveaux, il faut se rappeler que dans les sous-niveaux s Seuls 2 électrons s'inscrivent p Fit 6, dans le d Ils s'adaptent 10 et dans le F Ils s'adaptent 14.
Exceptions au début d'Aufbau
Le principe d'Aufbau établit clairement qu'un sous-niveau ne peut être rempli tant que tous les sous-niveaux précédents n'ont complètement rempli. Cependant, il y a quelques exceptions à cette règle.
Dans certains cas, l'atome préfère avoir un sous-niveau d'énergie rempli précisément en deux que pour en avoir un incomplet qui n'est pas plein de moitié. Dans ces cas, la configuration électronique réelle de l'atome ne correspond pas à l'ordre prévu par la méthode de pluie.
Par exemple, selon le principe d'Aufbau, l'atome chromé doit avoir une configuration électronique qui se termine par 4S2 3D4. Cependant, sa véritable configuration est 4S1 3D5 Puisque ainsi les sous-niveaux 4S et 3D sont remplis de moitié tandis que dans l'autre configuration non.
Il en va de même pour le cuivre dont la configuration se termine par 4S1 3Ddix, au lieu de 4S2 3D9, Puisqu'il remplit ainsi le sous-niveau D et S est plein de moitié.
Exemples de l'application du principe Aufbau
Ensuite, il existe 5 exemples d'éléments qui répondent au principe d'Aufbau:
Exemple 1: configuration électronique de sodium
Le sodium est l'élément 11, il a donc 11 protons et 11 électrons. Sa configuration électronique est 12 2s2 2 P6 3s1.
Exemple 2: Configuration électronique Argon
Argon (AR) est l'élément 18, il a donc 18 protons et 18 électrons. Sa configuration électronique est donc 12 2s2 2 P6 3s23p6. On peut voir que ses sous-niveaux et ses sous-niveaux étaient complètement.
Peut vous servir: propylène (C3H6)Exemple 3: Configuration électronique de gallium
Gallium (GA) est l'élément 31, il a donc 31 protons et 31 électrons. Sa configuration électronique est 12 2s2 2 P6 3s23p64s23Ddix4p1.
Cela peut être écrit de manière résumé comme [ar] 4s23Ddix4p1, où [ar] représente la configuration électronique de l'argon présentée dans l'exemple précédent.
Exemple 4: Configuration électronique du carbone
Le carbone (c) est l'élément 6, il a donc 6 protons et 6 électrons. Sa configuration électronique est 12 2s2 2 P2.
Exemple 5: Configuration électronique du chlore
Le chlore (CL) est l'élément 17. Ses 17 électrons sont distribués selon la configuration électronique suivante: 12 2s2 2 P6 3s23p5 ou [ne] 3s23p5.
Exemples supplémentaires d'exceptions au début d'Aufbau
Ensuite, il existe 2 exemples supplémentaires d'éléments qui violent le principe d'Aufbau:
Exemple 6: Configuration électronique molybdène
Le molybdène (MO) est l'élément 42. Les 36 premiers électrons sont distribués de la même manière que dans le crypton, mais ses électrons de valence ne suivent pas l'ordre normal. Au lieu d'avoir une configuration électronique [KR] 5S24d4, Sa configuration est [kr] 5s14d5, Semblable à ce qui se passe avec Chrome.
Exemple 7: Configuration électronique argentée
La Plata (AG, élément 47) présente une violation du principe d'Aufbau similaire à celui du cuivre. Sa configuration électronique est [KR] 5S14ddix Au lieu de [kr] 5s24d9.

