Fondation, procédure et utilisations du test oxydase
- 1789
- 354
- Prof Ines Gaillard
La test d'oxydase Il s'agit d'une méthode diagnostique qui montre la présence du complexe enzymatique appelé cytochrome oxydase C. Ce système induit la transformation du cytochrome réduit en oxydé, car il capture l'oxygène et cela agit à son tour comme le dernier accepteur d'électrons (H+) Dans la chaîne respiratoire.
Le terme oxydase est un moyen résumé de se référer à l'enzyme de cytochrome oxydase, également connue sous le nom d'oxydase indéfénol. Dans les temps anciens, on pensait que les enzymes de cytochrome oxydase et de l'indéophénol oxydase étaient deux enzymes différentes, mais aujourd'hui on sait qu'ils sont les mêmes.
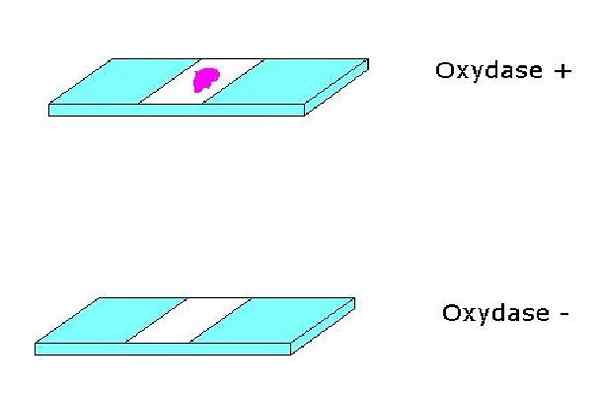
 Test d'oxydase positif et négatif. Source: Aucun auteur lisible par machine fourni. Alpha.Prim ~ Commonswiki a supposé (sur la base des réclamations du droit d'auteur). [Domaine public]
Test d'oxydase positif et négatif. Source: Aucun auteur lisible par machine fourni. Alpha.Prim ~ Commonswiki a supposé (sur la base des réclamations du droit d'auteur). [Domaine public] Pour leur part, les cytochromes sont des hémoprotéines qui contiennent du fer et complètent le système de cytochrome oxydase. Les cytochromes peuvent varier d'une espèce à une autre.
Il existe différentes variétés de cytochromes (cytochromes A1, A2, A3 et 0). Certaines bactéries ne peuvent en produire qu'un, mais d'autres jusqu'à deux ou trois en même temps. En ce sens, la présence de cytochrome A et A3 est connue sous le nom de cytochrome - oxydase C. C'est le type de cytochrome qui détecte le test d'oxydase.
Les genres Neisseria et Pseudomonas contiennent du cytocrome oxydase C. Ces genres donnent le test positif de l'oxydase, aidant à les différencier des genres Acinetobacter et Stenotrophomonas respectivement.
Il existe également d'autres genres qui sont une oxydase positive.
[TOC]
Base
Caractéristiques du système de cytochrome oxydase C
Le système de cychocrome d'oxydase C agit comme suit: les micro-organismes positifs de l'oxydase utilisent l'oxygène pour générer de l'énergie par la respiration aérobie. Ce système fonctionne grâce au transport d'électrons à partir de substances donneuses telles que NADH+ Vers la réception de substances, dans ce cas, l'oxygène.
Il en résulte de l'énergie (ATP) et du peroxyde d'eau, en fonction du système de cytochrome oxydase qui possède le micro-organisme.
C'est pourquoi la plupart des bactéries oxydases positives sont également une catalase positive, une condition nécessaire pour éliminer le peroxyde d'hydrogène produit, car cette substance est toxique pour les bactéries.
Le système du cytocrome oxydase C est présent dans certaines bactéries aérobies, certains anaérobies facultatifs, rares microaérophiles et sans stricte anaérobie. Ce dernier est compréhensible, car les anaérobies stricts ne peuvent pas vivre en présence d'oxygène, donc ils n'ont pas le système de cytochrome oxydase.
Principe de preuve
Dans ce test, utilisez des substances qui agissent comme des accepteurs d'électrons artificiels, remplaçant les indigènes dans la chaîne de transport d'électrons.
Principalement des colorants tels que la paraphénylendiamine et l'indophénol sont utilisés, qui agissent comme substrats récepteurs et donneurs d'électrons artificiels.
La paraphényndiamine est oxydée par le système de cytocrome oxydase C. Le colorant dans sa forme réduite est incolore, mais sous sa forme oxydée, il est coloré.
C'est ainsi que la présence du système Cytochrome oxydase C C; Eh bien, une réaction positive générera une lavande ou une coloration bleue -púrpura en fonction du réactif utilisé.
Peut vous servir: Paleobiologie: histoire, spécialités, découvertesD'un autre côté, si la dernière substance accepteur d'électrons dans la chaîne respiratoire est différente de l'oxygène, le test d'oxydase donnera négatif (il n'y a pas de production de couleurs); C'est le cas des micro-organismes anaérobies.
De même, si le cytochrome utilisé par le micro-organisme est différent de la cytochrome oxydase C, il donnera également le test négatif.
Procédure
Pour le test de l'oxydase, il existe plusieurs réactifs et protocoles, le tout avec le même but.
Réactifs
Kovacs Reactive, Gordon et McLeod Réactif, réactif Nadi, réactif de charpentier, Suhrland et Morrison, et l'utilisation de disques oxydases.
-Réactif kovacs oxydase
Il se compose de dichlorhydrate tétraméthyl-p-phénylindiamine à 1%.
Le réactif Kovacs est préparé en dissolvant 1 GR de la substance mentionnée dans 50 ml d'eau distillée. Il est subtilement chauffé jusqu'à sa solution totale. Transférer dans une bouteille ambrée de capacité suffisante et terminer le volume à 100 ml avec de l'eau distillée. Attendez au moins 15 minutes avant d'utiliser. Économisez dans le réfrigérateur protégé de la lumière.
Il est tourné en tant que réactif de Kovacs oxydase, pour le différencier du réactif Kovacs utilisé pour révéler le test indol. Ce réactif est le plus sensible, moins toxique mais plus cher que le reste des réactifs.
Une réaction positive sera la preuve. Une réaction négative est mise en évidence car il n'y a pas de changement de couleur dans la colonie ou il prend une légère coloration rose. Le milieu peut également s'assombrir, mais cela ne signifie pas une réaction positive.
Avec ce réactif, le temps de réaction est crucial, ce changement de couleur qui se produit entre 5 et 15 secondes est considéré comme une réaction positive.
-Réactif Gordon et McLeod
Il est composé de dichlorhydrate de diméthyl-p-phényléléniamine, également connu sous le nom de N-diméthyl-P-phénylendiamine ou P-amynodiméthylaniline P-amocorhydrate. Il est préparé comme décrit pour le réactif Kovacs oxydase, en remplacement de la substance impliquée.
Ce réactif est légèrement plus stable que le réactif de Kovacs oxydase, bien que tous les réactifs contenant la P-pénilendiamine soient instables.
Cette réaction est en retard.
-Réactif de nadi
Il est composé de 1% d'α-naftol dans de l'alcool éthylique (95% d'éthanol) et de 1% d'amimanyline. Le mélange est préparé à égalité et en utilisant de l'alcool éthylique absolu comme un dilant, jusqu'à ce que la quantité suffisante soit terminée pour 100 ml.
-Carpenter Reactive, Suhrland et Morrison
Il est composé de 1% de p-amynodiméthylalanine oxalate. Préparez-vous de la même manière à celle décrite pour le réactif Kovacs oxydase, changeant pour la substance correspondante.
Peut vous servir: chaîne alimentaire de la jungleAvec la solution prête, les bandes réactives sont préparées comme suit: Whatman 6-8 cm numéro 1.
Ils sont autorisés à sécher sans avoir de contact avec du métal, à enregistrer dans des pots avec des dessiccants et à garder au réfrigérateur. Ces bandes sont stables jusqu'à 6 mois.
C'est le réactif le plus stable de tous mentionnés, pouvoir durer en solution jusqu'à 6 mois. Un autre point en faveur est que le milieu ne colore pas autour de la colonie, s'il est utilisé directement sur la plaque.
L'apparition d'une couleur rouge est interprétée comme un test positif.
-Disques oxydases
Ce sont des disques commerciaux qui sont imprégnés de réactif pour le test oxydase. Il y a plusieurs marques commerciales sur le marché.
Son utilisation est assez pratique, car nous ne devons pas préparer de nouveaux réactifs, ce qui facilite le travail. Les résultats obtenus sont fiables tant que les disques sont correctement préservés.
Protocoles
Méthode de plaque directe, méthode indirecte sur papier et utilisation de disques imprégnés avec des réactifs oxydases.
-Méthode de plaque directe
2 ou 3 gouttes de l'un des réactifs susmentionnés sont ajoutés à cet effet directement sur la ou les colonies contenues dans une plaque moyenne de culture qui ne contient pas de glucose.
Le changement ou non la couleur des colonies est interprétée, pas le médium. Le temps de réaction valide dépend du réactif utilisé.
-Méthode indirecte sur papier
Coupez un morceau de papier filtre (Whatman N ° 1) à une taille de 6 cm2 Et il est placé à l'intérieur d'un Petri vide.
Ajouter 2 ou 3 gouttes du réactif Kovacs oxydase sur papier, participer à la colonie que vous souhaitez étudier avec une poignée en platine ou un bâton en bois et l'étendre en ligne droite sur le papier réactif imprégné. Interpréter dans une période de 5 à 10 secondes.
Avec les bandes préparées avec le réactif Carpenter, Suhrland et Morrison, une colonie s'étend sur la bande sèche. La même bande sert à essayer plusieurs souches. Interpréter sur 10 secondes.
-Disques (méthique directe)
Humidifèrent subtilement des disques commerciaux avec de l'eau distillée stérile et surmontez la colonie pour étudier. Il est recommandé d'utiliser les plaques à 35 ° C, si des plaques sont utilisées à température ambiante ou des plaques réfrigérées, la réaction est un peu plus lente. Interpréter le changement de couleur entre 10 et 20 s.
Les colonies contenues dans le sang ou le chocolat peuvent être utilisées.
-Disques (méthode indirecte)
Humidifiez l'album comme décrit ci-dessus. Placez-le sur un Petri vide. Prenez suffisamment de quantité de colonie pour étudier avec une poignée en platine ou un bâton en bois et placer sur le disque. Interpréter le changement de couleur entre 10 et 20 s.
Utiliser
Le genre Neisseria et Acinetobacter ressemblent parfois à beaucoup de morphologiquement parce que bien que le genre Acinetobacter soit un bacille à Gram négatif, il peut parfois adopter une forme coco-coïde et distribuer par paires, simulant le genre Neisseria.
Peut vous servir: limnologieDans ce cas, le test d'oxydase est vraiment utile. Le genre Neisseria est positif et négatif Acinetobacter.
Cependant, le genre Moraxella est très similaire au genre Neisseria et tous deux donnent une réaction positive; C'est pourquoi nous devons toujours effectuer des tests de fermentation des glucides pour une identification définitive.
D'un autre côté, le test d'oxydase est utile pour différencier une bactérie appartenant à la famille des entérobactéries (toutes oxydase négative) d'autres fermers, comme le genre de pâturage, les aéromones, les plésiomonas (oxydase positive).
Le genre Vibrio et Helicobacter sont également une oxydase positive.
Contrôle de qualité
Utiliser des souches connues de Escherichia coli comme contrôle négatif et souches de Pseudomonas aeruginosa comme contrôle positif.
Limites
-Les réactifs doivent être utilisés fraîchement préparés, leur durée de vie utile à température ambiante est courte pour être très instable. Le réfrigéré peut durer entre 5 jours et 2 semaines.
-Les réactifs sont incolores, s'ils changent de couleur, ils doivent être jetés. Les disques endommagés sont évidents car ils deviennent sombres avec le temps.
-Une réaction positive avec le réactif oxydase des Kovac entre 15 et 60 secondes est considérée comme une réaction retardée et après 60 secondes, elle doit être considérée comme négative.
-Il Haemophylus influenzae Il donne une réaction à l'oxydase négative si un réactif avec diméthyl-p-phénylénamine est utilisé, mais positif si le réactif oxydase des Kovacs (tétraméthyl-p-phénylindiamine) est utilisé utile).
-Les milieux contenant du glucose interfèrent dans le test, faussement négatif.
-Les souches de Bordetella pertussis Ils peuvent donner une réaction faussement positive si elles proviennent de plaques de gélose sanguine très concentrées.
-L'utilisation de poignées métalliques (fer) donnant une réaction faussement positive.
recommandations
-Parce que les réactifs sont très instables et ont tendance à s'auto-out.
-Une autre façon de retarder l'auto-out-out du réactif est d'ajouter 0,1% d'acide ascorbique au moment de la préparation des réactifs.
-Comme les réactifs sont instables, il est recommandé d'effectuer un contrôle de qualité hebdomadaire.
-Les réactifs qui ne réussissent pas le test de contrôle de la qualité ne doivent pas être utilisés.
Les références
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Diagnostic microbiologique. 5e ed. Pan -American Editorial S.POUR. Argentine.
- Forbes B, Sahm D, Weissfeld A. (2009). Diagnostic microbiologique de Bailey & Scott. 12 ed. Pan -American Editorial S.POUR. Argentine.
- "Test d'oxydase." Wikipedia, encyclopédie gratuite. Janvier 2018, 10:32 UTC. Avril 2019, 14:03
- Organisation mondiale de la SANTE. Manuel de laboratoire pour l'identification et le test de sensibilité aux antimicrobiens des agents pathogènes bactéries importants pour la santé publique dans le monde du développement.2004. Disponible à: qui.INT / DrugResistance / Infosharing
- Bandes réactives pour le diagnostic de l'activité de l'oxydase chez les bactéries. Rév. 2000; 52 (2): 150-151.
- « Unités administratives spéciales en Colombie
- Opportunité interne ce qui consiste et les exemples »

