Structure moléculaire de l'oxygène, propriétés, utilisations
- 2044
- 410
- Jade Duval
Il Oxygène moléculaire soit Dioxygène, Également appelé oxygène diatomique ou gazeux, c'est la forme élémentaire la plus courante dans laquelle cet élément se trouve sur la planète Terre. Sa formule est ou2, étant donc une molécule diatomique et homonucléaire, totalement apolaire.
L'air que nous respirons est composé d'environ 21% d'oxygène sous forme de molécules ou2. Plus nous montons, les concentrations d'oxygène de gaz diminuent et augmentent la présence d'ozone, ou3. Notre corps profite du O2 Pour oxygéner vos tissus et effectuer une respiration cellulaire.
 Sans oxygène, enrichir notre atmosphère, la vie serait un phénomène non durable. Source: Pixabay.
Sans oxygène, enrichir notre atmosphère, la vie serait un phénomène non durable. Source: Pixabay. Le o2 Il est également responsable de l'existence du feu: sans lui, il serait presque impossible d'avoir des incendies et des combustions. En effet2-.
L'oxygène moléculaire est essentiel pour d'innombrables processus aérobies, ayant des applications en métallurgie, en médecine et en traitement des eaux usées. Ce gaz est pratiquement synonyme de chaleur, de respiration, d'oxydation et, d'autre part, de températures congelées lorsqu'elle a à l'état liquide.
[TOC]
Structure de l'oxygène moléculaire
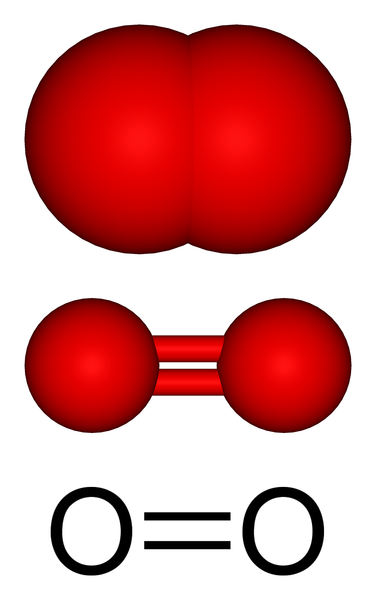
 Structure moléculaire d'oxygène gazeux. Source: Benjah-Bmm27 via Wikipedia.
Structure moléculaire d'oxygène gazeux. Source: Benjah-Bmm27 via Wikipedia. Dans l'image supérieure, nous avons la structure moléculaire de l'oxygène gazeux représenté avec plusieurs modèles. Au cours des deux derniers, les caractéristiques de la liaison covalente qui maintient les atomes d'oxygène sont mises en évidence: une double liaison o = o, dans laquelle chaque atome d'oxygène complète son octet de Valencia.
Peut vous servir: diastréomèresLa molécule ou2 Il est linéaire, homonucléaire et symétrique. Sa double liaison a une longueur de 121 h. Cette courte distance rend une certaine énergie considérable requise (498 kJ / mol) pour briser la liaison o = o, et est donc une molécule relativement stable.
Si c'est le cas, l'oxygène de l'atmosphère aurait complètement dégradé avec le temps, ou l'air ne prendrait feu sur rien.
Propriétés
Apparence physique
L'oxygène moléculaire est un gaz incolore, insipide et inodore, mais lors de la condensation et de la cristallisation acquiert des tons bleuâtres.
Masse molaire
32 g / mol (valeur arrondie)
Point de fusion
-218 ºC
Point d'ébullition
-183
Solubilité
L'oxygène moléculaire n'est pas très soluble dans l'eau, mais suffisamment pour soutenir la faune marine. Si votre solubilité était plus grande, il serait moins susceptible de mourir de noyade. D'un autre côté, sa solubilité est beaucoup plus grande dans les huiles et les liquides apolaires, pouvoir les oxyder lentement et ainsi affecter leurs propriétés d'origine.
Énergies états
L'oxygène moléculaire est une substance qui ne peut pas être complètement décrite par la théorie de la liaison Valencia (TEV).
La configuration électronique de l'oxygène est la suivante:
[Il] 2s² 2p⁴
Il a une paire d'électrons manquants (ou :). Lorsque deux atomes d'oxygène sont trouvés, ils sont liés pour former une double liaison O = O, terminant à la fois l'octet de Valence.
Par conséquent, la molécule ou2 Il doit être diamagnétique, avec tous ses électrons appariés. Cependant, c'est une molécule paramagnétique, et cela s'explique par le diagramme de ses orbitales moléculaires:
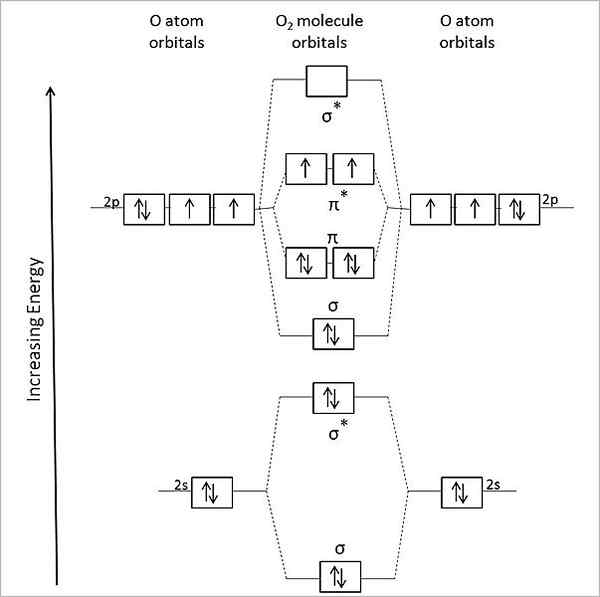 Diagramme orbital moléculaire pour l'oxygène du gaz. Source: Anthony.Sebastian / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Diagramme orbital moléculaire pour l'oxygène du gaz. Source: Anthony.Sebastian / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) Ainsi, la théorie orbitale moléculaire (Tom) décrit mieux l'Or2. Les deux électrons manquants sont situés dans les orbitales moléculaires π*, d'une plus grande énergie et donnez de l'oxygène avec leur caractère paramagnétique.
Peut vous servir: méthylamine: structure, propriétés, production, utilisationsEn fait, cet état d'énergie correspond à l'oxygène triplet, 3SOIT2, Le plus prédominant de tous. L'autre état énergétique de l'oxygène, moins abondant sur Terre, est le célibataire, 1SOIT2.
Transformations
L'oxygène moléculaire est considérablement stable tant qu'il n'est en contact avec aucune substance susceptible d'oxyder, encore moins s'il n'y a pas de source étroite de chaleur intense, comme une étincelle. C'est parce que o2 Il a une forte tendance à réduire, à gagner des électrons d'autres atomes ou molécules.
Lorsqu'il est réduit, il est capable d'établir un large éventail de liens et de formes. S'il forme des liaisons covalentes, il le fera avec moins d'atomes électronégatifs que lui, y compris l'hydrogène, pour créer de l'eau, H-O-H. Il peut également s'agir d'univers de carbone, pour provoquer des liaisons C-O et plusieurs types de molécules organiques oxygénées (Étéres, cétones, aldéhydes, etc.).
Le o2 Vous pouvez également gagner des électrons pour vous transformer dans les peroxydes et les superoxydes, ou22- je2-, respectivement. Lorsqu'il devient du peroxyde dans l'organisme, le peroxyde d'hydrogène est obtenu, h2SOIT2, H-O-O-H, un composé nocif traité par l'action d'enzymes spécifiques (peroxydases et catalas).
D'un autre côté, et notamment, le O2 réagit avec la matière inorganique pour devenir anion oxyde, ou2-, Composer une liste sans fin de masses minéralogiques qui gonflent l'écorce et le manteau terrestre.
Applications
Soudures et combustion
 L'oxygène est utilisé pour combustion acétylène et tirer une flamme de chaleur intense qui est précieuse dans les soudures. Source: Sheila / CC par (https: // CreativeCommons.Org / licences / par / 2.0)
L'oxygène est utilisé pour combustion acétylène et tirer une flamme de chaleur intense qui est précieuse dans les soudures. Source: Sheila / CC par (https: // CreativeCommons.Org / licences / par / 2.0) L'oxygène est utilisé pour effectuer la réaction de combustion, par laquelle une substance est exothermiquement dégageant le feu. Ce feu et sa température varient en fonction de la substance qui brûle. Ainsi, des flammes très chaudes peuvent être obtenues, comme l'acétylène (ci-dessus), avec laquelle les métaux et les alliages sont soudés.
Peut vous servir: enthalpieSi ce n'est pas pour l'oxygène, les carburants ne pouvaient pas brûler et fournir toute leur énergie calorique, utilisé pour enlever les roquettes ou pour démarrer des voitures.
Agent oxydant en chimie verte
Grâce à ce gaz, un oxydes organiques et inorganiques sans fin est synthétisé ou produit industriel. Ces réactions sont basées sur le pouvoir oxydant de l'oxygène moléculaire, étant également l'un des réactifs les plus viables de la chimie verte pour obtenir des produits pharmaceutiques.
Respiration assistée et traitement des eaux usées
L'oxygène est vital pour répondre.
De même, l'oxygène «nourrit» les bactéries aérobies, qui aident à dégrader la contamination des déchets des eaux usées, ou aident à respirer les poissons, dans des cultures aqueuses pour la protection ou le commerce.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (quatrième édition). Mc Graw Hill.
- Wikipédia. (2020). Allotropes d'oxygène. Récupéré de: dans.Wikipédia.org
- Hone, C.POUR., Kappe, C.SOIT. (2019). L'utilisation d'oxygène moléculaire pour les oxydations aérobies de phase liquide dans un flux continu. Top Curr Chem (Z)377, 2. est ce que je.org / 10.1007 / S41061-018-0226-Z
- Kevin Beck. (28 janvier 2020). 10 utilisations de l'oxygène. Récupéré de: science.com
- Falaises. (2020). Biochimie I: La chimie de l'oxygène moléculaire. Récupéré de: Cliffsnotes.com
- Fournitures industrielles GZ. (2020). Avantages industriels de l'oxygène gazeux. Récupéré de: Supplies GZ.com
- « Culture des traditions du Portugal, des coutumes, de la gastronomie, de la religion
- Formule et équations d'interférence destructrices, exemples, exercice »

