Numéro de masse en quoi il consiste et comment l'obtenir (avec des exemples)
- 3485
- 5
- Noa Da silva
Il Nombre de masse o Le nombre de masse d'un atome est la somme du nombre de protons et de la quantité de neutrons de noyau. Ces particules sont désignées de manière interchangeable avec le nom de Nucléones, Par conséquent, le nombre de masse représente la quantité d'entre eux.
Soit n le nombre de neutrons présents et z le nombre de protons, si nous appelons comment le numéro de masse, alors:
A = n + z
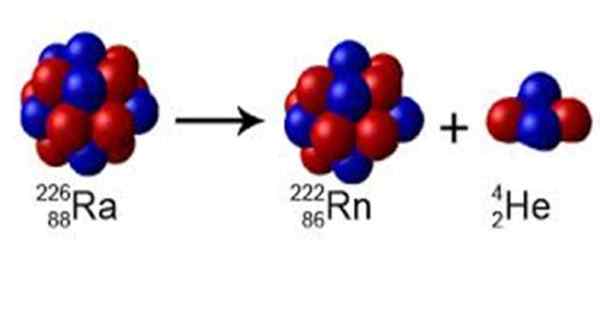
 Figure 1. La radio a un nombre de masse A = 226, il se désintègre au radon avec A = 222 et émet un noyau d'hélium de A = 4. Source: Wikimedia Commons. Perox [CC0] [TOC]
Figure 1. La radio a un nombre de masse A = 226, il se désintègre au radon avec A = 222 et émet un noyau d'hélium de A = 4. Source: Wikimedia Commons. Perox [CC0] [TOC]
Exemples de nombres de masse
Immédiatement quelques exemples de nombres de masse pour des éléments bien connus:
Hydrogène
L'atome d'hydrogène le plus stable et le plus abondant est également le plus simple: 1 proton et un électron. Puisque le noyau d'hydrogène n'a pas de neutrons, il est vrai que a = z = 1.
Oxygène
Un noyau d'oxygène a 8 neutrons et 8 protons, donc a = 16.
Carbone
La durée de vie sur Terre est basée sur la chimie du carbone, un atome léger avec 6 protons dans son noyau plus 6 neutrons, comme a = 6 + 6 = 12.
Uranium
Cet élément lourd que les précédents est bien connu pour ses propriétés radioactives. Le noyau d'uranium compte 92 protons et 146 neutrons. Ensuite, votre numéro de masse est a = 92 + 146 = 238.
Comment obtenir le numéro de masse?
Comme dit précédemment, le nombre de masse a d'un élément correspond toujours à la somme du nombre de protons et au nombre de neutrons contenant son noyau. C'est aussi un entier, mais ... y a-t-il une règle en termes de relation entre les deux quantités?
Voyons: tous les éléments mentionnés ci-dessus sont légers, sauf l'uranium. L'atome d'hydrogène est, comme nous l'avons dit, le plus simple. Il n'a pas de neutrons, du moins dans sa version la plus abondante, et en oxygène et en carbone, il y a un nombre égal de protons et de neutrons.
Il peut vous servir: quelle est l'essuyage des émissions? (Avec des exemples)Cela se produit également avec d'autres éléments légers, comme l'azote, un autre gaz très important pour la vie, qui a 7 protons et 7 neutrons. Cependant, comme le noyau est plus complexe et que les atomes deviennent plus lourds, le nombre de neutrons augmente avec un autre rythme.
Contrairement aux éléments légers, l'uranium, avec 92 protons, a environ 1 ½ fois cette quantité en neutrons: 1 ½ x 92 = 1.5 x 92 = 138.
Comme vous pouvez le voir, il est assez proche de 146, la quantité de neutrons qu'il a.
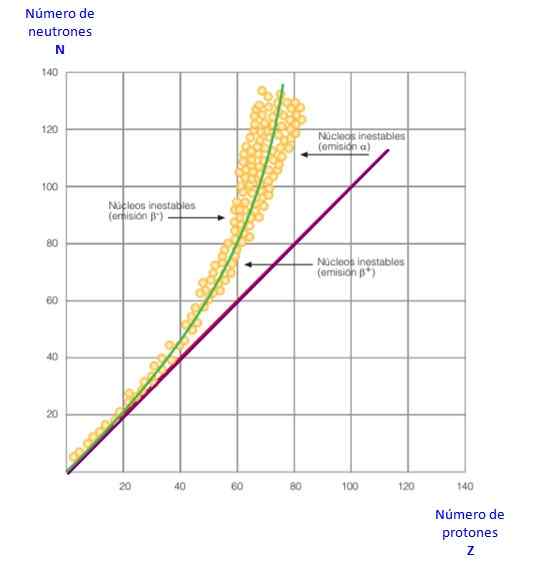 Figure 2. Courbe de stabilité. Source: F. Zapata.
Figure 2. Courbe de stabilité. Source: F. Zapata. Tout cela devient évident dans la courbe de la figure 2. C'est un graphique de n contre z, appelé courbe de stabilité nucléaire. Là, on peut voir comment les atomes légers ont le même nombre de protons que les neutrons, et comment de z = 20 le nombre de neutrons augmente.
De cette façon, le grand atome devient plus stable, car l'excès de neutrons diminue la répulsion électrostatique entre les protons.
Notation pour les atomes
Une notation très utile qui décrit rapidement le type d'atome est la suivante: Le symbole de l'élément et les nombres atomiques et de masse respectifs sont écrits comme indiqué ci-dessous dans ce schéma:
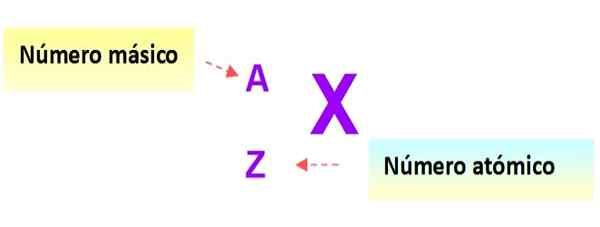 figure 3. Notation de l'atome. Source: F. Zapata.
figure 3. Notation de l'atome. Source: F. Zapata. Dans cette notation, les atomes des exemples précédents seraient:

Parfois, une autre notation plus confortable est utilisée, dans laquelle seul le symbole de l'élément et le numéro de masse pour indiquer l'atome est utilisé, omettant le numéro atomique. De cette façon, le 12 6C est écrit simplement comme le carbone-12, le 16 8Ou ce serait oxygène-16 et donc pour tout élément.
Peut vous servir: demi-cercle: comment calculer le périmètre, la zone, le centroïde, les exercicesLes isotopes
Le nombre de protons dans un noyau détermine la nature de l'élément. Par exemple, chaque atome dont le noyau contient 29 protons est un atome de cuivre, quoi qu'il arrive.
Supposons qu'un atome de cuivre perde un électron pour une raison quelconque, mais c'est toujours du cuivre. Cependant, maintenant c'est un atome ionisé.
Il est plus difficile pour un noyau atomique de gagner ou de perdre un proton, mais dans la nature, cela peut se produire. Par exemple, à l'intérieur des étoiles, des éléments plus lourds formés à partir d'éléments légers, car le noyau d'étoile se comporte comme un réacteur à fusion.
Et ici sur Terre, il y a le phénomène du désintégration radioactive, dans lequel certains atomes instables expulsent les nucléons et émettent de l'énergie, se transformant en autres éléments.
Enfin, il y a la possibilité qu'un atome d'un certain élément ait un nombre de masse différent, dans ce cas, c'est un isotope.
Un bon exemple est le carbone-14 bien connu ou radiocarbone, qui est utilisé pour sortir avec des objets archéologiques et comme traceur biochimique. C'est le même carbone, avec des propriétés chimiques identiques, mais avec deux neutrons supplémentaires.
Le carbone-14 est moins abondant que le carbone-12, l'isotope stable, et est également radioactif. Cela signifie qu'au fil du temps, il se désintègre en émettant de l'énergie et des particules jusqu'à ce qu'elle devienne un élément stable, qui dans son cas est l'azote.
Isotopes de carbone
Le carbone existe dans la nature comme un mélange de plusieurs isotopes, dont le plus abondant est le susmentionné 12 6C ou carbone-12. Et en plus du carbone-14 est le 13 6C avec un neutron supplémentaire.
Peut vous servir: des circuits de courant alternatifs: types, applications, exemplesCeci est de nature commune, par exemple de TIN, 10 isotopes stables sont connus. D'un autre côté, un seul isotope est connu sous le nom de béryllium et de sodium.
Chaque isotope, naturel ou artificiel, a un rythme de transformation différent. De la même manière, il est possible de créer des isotopes artificiels en laboratoire, qui sont généralement instables et se décomposent radioactivement dans une très brève période de deuxième fractions, tandis que d'autres prennent beaucoup plus, autant que l'âge de la terre ou plus.
Table d'isotopes de carbone naturel
| Isotopes de carbone | Numéro atomique Z | Numéro de masse A | Abondance % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 13 6 C | 6 | 13 | 1.onze |
| 14 6 C | 6 | 14 | Traces |
Exemples résolus
- Exemple 1
Quelle est la différence entre 13 7 N et 14 7 N?
Répondre
Les deux sont des atomes d'azote, car leur nombre atomique est de 7. Cependant, l'un des isotopes, qui a un = 13, a un neutron moins 14 7 N est l'isotope le plus abondant.
- Exemple 2
Combien de neutrons y a-t-il dans le noyau d'un atome de mercure, désigné comme 201 80 HG?
Répondre
Depuis A = 201 et Z = 80, et sachant aussi:
A = z + n
N = a - z = 201 - 80 = 121
Et il est conclu que l'atome de mercure a 121 neutrons.
Les références
- Connor, n. Qu'est-ce que Nucleon - Structure du noyau atomique - Définition. Récupéré de: périodique.org.
- Chevalier, r. 2017. Physique pour les scientifiques et l'ingénierie: une approche stratégique. Pearson.
- Sears, Zemansky. 2016. Physique universitaire avec physique moderne. 14e. Élégant. 2ieme volume.
- Tippens, P. 2011. Physique: concepts et applications. 7e édition. McGraw Hill.
- Wikipédia. Nombre de masse. Récupéré de: dans.Wikipédia.org.
- « Nitrate de magnésium (mg (NO3) 2) Structure, propriétés, utilisations
- Coplanares Points Equation, exemple et exercices résolus »

