Nitrate de magnésium (mg (NO3) 2) Structure, propriétés, utilisations

- 4458
- 1139
- Prof Ines Gaillard
Il Nitrate de magnésium C'est un solide inorganique dont la formule chimique est Mg (non3)2. C'est un composé ionique formé par l'union d'un cation magnésium mag2+ et deux anions de nitrate non3-.
Le MG (non3)2 C'est un solide blanc cristallin. C'est très hygroscopique, c'est-à-dire qu'il absorbe facilement l'eau de l'environnement. En restant en contact avec l'air de l'environnement, il a tendance à former son hexahydrate Mg (non3)2 •6h2SOIT.
 Mg de nitrate de magnésium (non3)2 en poudre. Ondřej MANGL [Domaine public]. Source: Wikimedia Commons.
Mg de nitrate de magnésium (non3)2 en poudre. Ondřej MANGL [Domaine public]. Source: Wikimedia Commons. Mag nitrate hexahydrate (non3)2 •6h2O il a dans sa structure cristalline 6 molécules d'eau H2Ou pour chaque molécule Mg (non3)2. Le nitrate de magnésium se trouve dans les cavernes et les mines sous forme de minéral de nitromagnésite.
Le MG (non3)2 Il est obtenu commercialement en réagissant le métal Mg avec un acide nitrique HNO3.
Il a des utilisations très variées, comme l'agriculture comme engrais car il fournit des éléments nutritifs pour les plantes telles que l'azote (N) et le magnésium (Mg).
Il est utilisé dans l'industrie des feux d'artifice ou la pyrotechnique et également pour obtenir de l'acide nitrique concentré. Il est utilisé dans l'analyse chimique, dans les expériences de physique et les études médicales et scientifiques.
[TOC]
Structure
Le nitrate de magnésium anhydro est formé par un cation magnésio mg2+ et deux anions de nitrate non3-.
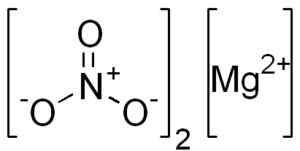 Structure Mg (non3)2. Edgar181 [domaine public]. Source: Wikimedia Commons.
Structure Mg (non3)2. Edgar181 [domaine public]. Source: Wikimedia Commons. Le magnésio mg ion2+ Il a une configuration électronique: 12, 2s2 2 P6, 3s0, Eh bien, les deux électrons de la couche la plus externe (3S) ont donné. Cette conformation est très stable.
L'ion non3- Il a une structure plate et symétrique.
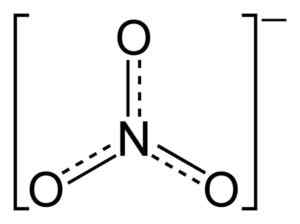 Structure d'ions nitrate plate non3-. Les lignes pointillées indiquent la distribution équitable des électrons entre les trois liaisons N-O. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structure d'ions nitrate plate non3-. Les lignes pointillées indiquent la distribution équitable des électrons entre les trois liaisons N-O. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Dans la structure de non3- La charge négative est répartie en continu entre les trois atomes d'oxygène.
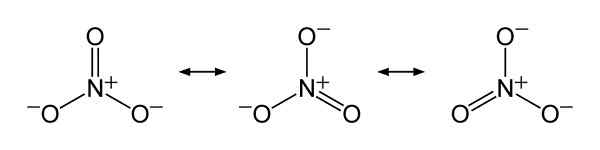 Structures de résonance nitrate non3-, Pour expliquer la distribution équitable de la charge négative entre les trois atomes d'oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structures de résonance nitrate non3-, Pour expliquer la distribution équitable de la charge négative entre les trois atomes d'oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Nomenclature
-Nitrate de magnésium anhydro: mg (non3)2
Peut vous servir: eau distillée-Nitrate de magnésium dihydraté: Mg (non3)2 •2h2SOIT
-Nitrate de magnésium hexahydraté: mg (non3)2 •6h2SOIT
-Dinitrate de magnésium
Propriétés
État physique
-Mg (non3)2 Anhydre: cristaux blancs blancs, cubes.
-Mg (non3)2 Dihydrado: solide blanc cristallin.
-Mg (non3)2 Hexahidered: Solide incolore, cristaux monocliniques
Poids moléculaire
-Mg (non3)2 Anhydre: 148,31 g / mol
-Mg (non3)2 Hexahydrate: 256,41 g / mol
Point de fusion
-Mg (non3)2 Hexahydrate: 88,9 ºC
Point d'ébullition
-Mg (non3)2 Hexahydrate: ne pas bouillir, décomposer à 330 ° C
Densité
-Mg (non3)2 Anhydre: 2,32 g / cm3
-Mg (non3)2 Dihydared: 1 456 g / cm3
-Mg (non3)2 Hexahydrate: 1 464 g / cm3
Solubilité
Le nitrate de magnésium anhydro est très soluble dans l'eau: 62,1 g / 100 ml à 0 ºC; 69,5 g / 100 ml à 20 ºC. Il est également très hygroscopique, être en contact avec l'air forme rapidement hexahydrate.
Le MG (non3)2 Le dihydrado est également très soluble dans l'eau et l'éthanol. C'est hygroscopique.
Le MG (non3)2 L'hexahydrate est également très soluble dans l'eau. Il est modérément soluble dans l'éthanol. C'est le plus stable des trois en contact avec l'air, c'est-à-dire que les trois est celui qui absorbe le moins l'eau de l'environnement.
Effet de chauffage
En soumettant une solution aqueuse de Mg (non3)2 Pour l'évaporation de l'eau, le sel qui cristallise est l'hexahydrate: mg (non3)2 •6h2SOIT. Hexahydrate signifie que dans le solide chaque molécule Mg (non3)2 Il est lié à 6 molécules d'eau.
Il y a aussi du mg dihydraté (non3)2 •2h2Ou, dans lequel le mg (non3)2 le solide est attaché à 2 molécules d'eau.
Chauffage mg hexahydrate (non3)2 •6h2Ou le sel d'anhydrate n'est pas obtenu, car le nitrate de magnésium a une forte affinité pour l'eau.
Pour cette raison, en le chauffant au-dessus de son point de fusion, un sel de nitrate mixte et un hydroxyde de magnésium Mg (non3)2 •4 mg (OH)2.
Ce sel mélangé, lorsqu'il atteint 400 ºC, se décompose en oxyde de magnésium et détachez les gaz d'oxydes d'azote.
Il peut vous servir: Hypochlorite de calcium (CA (CLO) 2)Obtention
Il peut être préparé en réagissant au carbonate de magnésium MGCO3 Avec l'acide nitrique HNO3, abandonner le dioxyde de carbone co2:
MGCO3 + 2 HNO3 → mg (non3)2 + CO2↑ + H2SOIT
Il peut également être obtenu avec un hydroxyde de magnésium Mg (OH)2 et acide nitrique:
Mg (oh)2 + 2 HNO3 → mg (non3)2 + 2 h2SOIT
Obtenu commercialement de plusieurs manières:
1- réagissant Magnesio Mg avec l'acide nitrique HNO3.
2- par réaction de l'oxyde de magnésium MgO avec l'acide nitrique HNO3.
3- JOING MG (OH) Hydroxyde de magnésium2 et nitrate d'ammonium NH4NON3, formant du nitrate de magnésium avec un détachement d'ammoniac NH3.
Emplacement dans la nature
Le MG (non3)2 L'hexahydrate se trouve naturellement dans les mines et les grottes ou les cavernes sous forme de minéral de nitromagnésite.
Ce minéral est présent lorsque le guano entre en contact avec des rochers riches en magnésium. Le guano est le matériau résultant des excréments des oiseaux marins et des phoques dans des environnements très secs.
Applications
Le MG (non3)2 Hexahydrate est utilisé dans les industries de la céramique, de la chimie et de l'agriculture.
Ce composé est un engrais car il fournit de l'azote (N), qui est l'un des trois éléments de base requis par les plantes, et le magnésium (mg) qui est également un composant secondaire également important pour ces.
De cette façon, il est utilisé avec d'autres ingrédients dans les serres et dans la culture hydroponique. Ce dernier doit faire pousser des plantes dans une solution aqueuse avec des sels d'engrais au lieu du sol.
 Culture hydroponique. Vous pouvez voir les canaux à travers lesquels la solution aqueuse avec des sels d'engrais tels que le nitrate de magnésium MG circule (non3)2. Auteur: Marsraw. Source: Pixabay.
Culture hydroponique. Vous pouvez voir les canaux à travers lesquels la solution aqueuse avec des sels d'engrais tels que le nitrate de magnésium MG circule (non3)2. Auteur: Marsraw. Source: Pixabay. Il est également utilisé comme catalyseur pour obtenir des composés pétrochimiques. Vous permet d'ajuster la viscosité dans certains processus. Le nitrate de magnésium anhydro est utilisé en pyrotechnique, c'est-à-dire pour la fabrication de feux d'artifice.
 Les feux d'artifice contiennent du nitrate de magnésium MG (non3)2. Auteur: Free-Goos. Source: Pixabay.
Les feux d'artifice contiennent du nitrate de magnésium MG (non3)2. Auteur: Free-Goos. Source: Pixabay. Le nitrate de magnésium anhydro est un agent déshydratant. Il est utilisé par exemple pour obtenir de l'acide nitrique concentré, car il élimine l'eau et concentre des vapeurs d'acide jusqu'à 90 à 95% des HNO3.
Peut vous servir: règle diagonale Acide nitrique concentré. Le téléchargeur d'origine était fabuleux chez italien Wikipedia. [Gfdl (http: // www.gnou.Org / copyleft / fdl.html)]. Source: Wikimedia Commons.
Acide nitrique concentré. Le téléchargeur d'origine était fabuleux chez italien Wikipedia. [Gfdl (http: // www.gnou.Org / copyleft / fdl.html)]. Source: Wikimedia Commons. Il est également utilisé pour couvrir le nitrate d'ammonium et permettre la formation de perles de ce matériau comprimé.
Il possède une utilité dans la formulation de l'encre, le toner (poudre noire utilisée dans les systèmes photocopiés) et les produits à colorier. Il sert de norme de magnésium en chimie analytique.
Magnésium et Cerio Mg de nitrate de sel (non3)2 •Dîne3)3 Il est intéressant pour les expériences de physique à basse température, car elle est utilisée comme réfrigérant dans des expériences adiabatiques de sumagnetisation (sans transfert de chaleur).
Ce magnésium et cerio sel ont été utilisés pour établir des niveaux de températures extrêmement basses de l'échelle de Kelvin (près du zéro absolu).
Dans des études récentes
Plusieurs chercheurs ont utilisé MG (non3)2 Dans les compositions avec des polymères synthétiques et naturels pour augmenter la conductivité dans les batteries de magnésio.
Il a également été étudié dans la construction de Supercaugades pour un stockage d'énergie à haute puissance.
Dans les études de maladie
Le nitrate de magnésium a été administré à des rats de laboratoire souffrant d'hypertension artérielle (haute pression) et il a été constaté que la pression artérielle diminue et atténue ou adoucit les effets des complications de cette maladie.
Il a également démontré des effets protecteurs contre les troubles neurologiques (trouble dans les neurones) et contre la mort chez le rat pendant les processus de caconage de l'artère carotide.
Les références
- Qian, m. et al. (2018). Carbones poreux à quelques couches poreux à haute capacité de la combustion de pechini de gel de nitrate de magnésium. ACS Appl Mater Interfaces 2018, 10 (1): 381-388. NCBI a récupéré.NLM.NIH.Gouvernement.
- Manjuladevi, r. et al. (2018). Une étude sur l'électrolyte en polymère de mélange basé sur le poly. Ionics (2018) 24: 3493. Lien récupéré.Springer.com.
- Kiruthika, s. et al. (2019). Électrolyte biopolymère écologique, pectine au sel de nitrate de magnésium, pour application dans des dispositifs électrochimiques. J Solid State Electochem (2019) 23: 2181. Lien récupéré.Springer.com.
- Vilskerts r. et al. (2014). Le nitrate de magnésium atténue l'augmentation de la pression artérielle chez les rats SHR. Magnes Res 2014, 27 (1): 16-24. NCBI a récupéré.NLM.NIH.Gouvernement.
- Kuzenkov V.S. et krushinskii a.L. (2014). Effet protecteur du nitrate de magnésium contre les troubles neurologiques provoqués par l'ischémie cérébrale chez le rat. Bull Exp Biol Med 2014, 157 (6): 721-3. NCBI a récupéré.NLM.NIH.Gouvernement.
- Ropp, r.C. (2013). Groupe 15 (N, P, AS, SB et BI) Composés de la Terre alcaline. Nitrate de magnésium. Dans l'encyclopédie des composés terrestres alcalins. Récupéré de ScienceDirect.com.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Volume 1. Quatrième édition. John Wiley & Sons.
- OU.S. Bibliothèque nationale de médecine. (2019). Nitrate de magnésium. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- « Concept et caractéristiques du système technique, éléments, exemples
- Numéro de masse en quoi il consiste et comment l'obtenir (avec des exemples) »

