Structure chimique du nitrate de baryum, utilisations, propriétés

- 1751
- 100
- Eva Henry
Il nitrate de baryum Il s'agit d'un sel composé d'un atome de baryum (BA) et d'un ion nitrate (non3). Il est présenté comme un solide cristallin blanc à température ambiante et existe dans la nature comme un minéral très rare connu sous le nom de nitrobarita. Ses propriétés en font un composé toxique qui doit être soigneusement géré.
En fait, ce composé a plusieurs utilisations dans l'industrie militaire, car elle peut être liée à d'autres substances chimiques et ajoutée aux formulations explosives et incendiaires, entre autres.
 Apparence de nitrate de baryum. Source: W. Oelen / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Apparence de nitrate de baryum. Source: W. Oelen / CC By-SA (https: // CreativeCommons.Org / licences / by-sa / 3.0) [TOC]
Formule
Le nitrate de baryum, également appelé dyitrate de baryum, a la formule chimique BA (non3)2, et est généralement fabriqué par deux méthodes.
Le premier d'entre eux implique la dissolution de petits morceaux de carbonate de baryum (Bacchus3) Dans un milieu de milieu acidique (HNO3, un acide minéral hautement corrosif), permettant aux impuretés de fer de précipiter, puis ce mélange est filtré, évaporé et cristallisé.
La deuxième méthode se fait par la combinaison de chlorure de baryum (BACL2, Un des sels de baryum d'une plus grande solubilité dans l'eau) avec une solution préchauffée de nitrate de sodium. Cela génère une réaction qui se traduit par la séparation des cristaux de nitrate de baryum au mélange.
Structure chimique du nitrate de baryum
Ce sel présente les caractéristiques de la structure cristalline cubique ou des octaedros anhydres.
Sa structure chimique est la suivante:
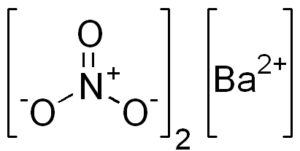
Dissociation
À des températures élevées (592 ºC), le nitrate de baryum se décompose pour former de l'oxyde de baryum (BAO), du dioxyde d'azote (non2) et l'oxygène (ou2), Selon la réaction chimique suivante:
Peut vous servir: hydroxyde de Beryl (être (oh) 2)2ba (non3)2 + Chauffer → 2bao + 4no2 +SOIT2
Dans les milieux à fortes concentrations d'oxyde nitrique (NO), la décomposition du nitrate de baryum produit un composé appelé nitrite de baryum (BA (NO2)2), Selon l'équation suivante:
Salle de bains3)2 + 2No → BA (Non2)2 + 22
Réactions avec des sulfates de métal soluble ou d'acide sulfurique (H2Swin4) générer du sulfate de baryum (Baso4). La grande majorité des sels de baryum insolubles, comme le carbonate (Bacchus3), Oxalate (BAC2SOIT4) ou phosphate métallique (BA3(PO4)2), sont précipités par des réactions de double décomposition similaires.
Utilisation du nitrate de baryum
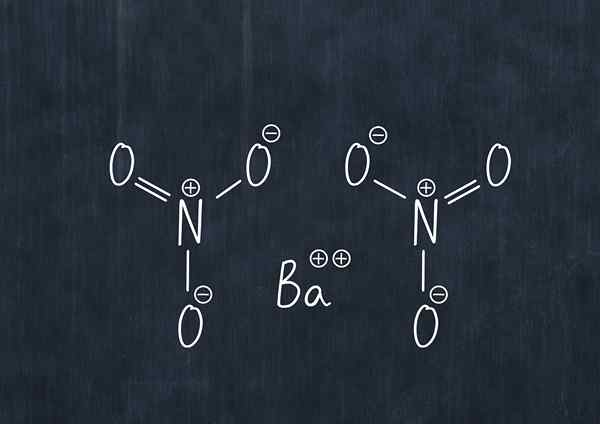 Formule chimique du nitrate de baryum
Formule chimique du nitrate de baryum Cette substance en poussière est un agent oxydant et réagit considérablement avec les agents réducteurs communs.
Lorsque ce sel est mélangé à d'autres métaux, comme l'aluminium ou le zinc dans ses formes finement divisées, ou avec des alliages tels que l'aluminium-Magn0esio, il s'allume et exploite l'impact. Pour cette raison, le nitrate de baryum est considéré comme une excellente composante des armes militaires et des explosifs.
Avec trinitrotoluène (commercialement connu sous le nom de TNT, ou C6H2(NON2)3Ch3) Et un liant (cire régulièrement de la paraffine), ce sel forme un composé appelé Baratol, qui a des propriétés explosives. La forte densité de nitrate de baryum fait acquérir le Baratol, ce qui le rend plus efficace dans sa fonction.
Le nitrate de baryum rejoint également la poussière d'aluminium, une formule qui se traduit par la formation de poudre à canon clignotante, qui est principalement utilisée dans les feux d'artifice et la pyrotechnique théâtral.
Ce flash a également vu des utilisations dans la production de fusées éclairantes (comme les mesures antimiles des avions) et dans des grenades stupéfaites. De plus, cette substance est très explosive.
Il peut vous servir: cyanure de sodium (NACN): structure, propriétés, risques, utilisationsCe sel est combiné avec le mélange de réactif appelé thermite pour former une variation de cet terme ainsi appelé, qui génère des éclairs courts et très puissants de températures élevées dans de petites zones pendant une courte période.
Le Termate-TH3 est un terme qui contient une composition de 29% par le poids du nitrate de baryum, ce qui aide à augmenter l'effet thermique, à générer des flammes et à réduire considérablement la température d'allumage du terme.
Les theroot sont généralement utilisés dans la production de grenades incendiaires et ont la fonction de détruire l'armure et les structures du réservoir militaire.
De plus, le nitrate de baryum était l'un des ingrédients les plus utilisés dans la production d'accusations incendiaires utilisées par les Britanniques dans leurs avions de guerre pendant la Seconde Guerre mondiale, qui armé de munitions incendiaires qui ont servi à détruire les avions ennemis.
Enfin, ce sel a des utilisations dans le processus de fabrication de l'oxyde de baryum, dans l'industrie de la valve thermionique et, comme déjà dit, dans la création de pyrotechniques, en particulier celles des couleurs vertes.
Proprietes physiques et chimiques
 Nitrato bario bai (NO3) 2
Nitrato bario bai (NO3) 2 Le sel est présenté comme un solide blanc, hygroscopique et des toilettes, qui est peu soluble dans l'eau et totalement insoluble dans les alcools.
Il a une masse molaire de 261 337 g / mol, une densité de 3,24 g / cm3 et un point de fusion de 592 ºC. En atteignant son point d'ébullition, il se décompose, comme cela a été dit ci-dessus. À température ambiante, il a une solubilité en eau de 10,5 g / 100 ml.
Il est considéré comme stable, mais c'est un agent oxydant fort et doit être loin des matériaux combustibles pour éviter le feu. Il a une sensibilité à l'eau et ne doit pas être mélangé avec des acides ou anhydre.
Peut vous servir: Isothermes d'adsorption: concept, types, exemplesEn concentrations élevées (par exemple, les conteneurs) doivent être isolés de substances qui peuvent la réagir, car elle peut exploiter violemment.
Comme tout autre composé soluble de baryum, c'est une substance toxique pour les animaux et les êtres humains.
Il ne doit pas être inhalé ou consommé, car les symptômes d'empoisonnement (en particulier le durcissement des muscles faciaux), les vomissements, la diarrhée, les douleurs abdominales, les tremblements musculaires, l'anxiété, la faiblesse, la détresse respiratoire, l'irrégularité cardiaque et les convulsions et les convulsions.
La mort peut se produire après un empoisonnement avec cette substance, quelques heures ou quelques jours après avoir présenté.
L'inhalation du nitrate de baryum génère une irritation dans la muqueuse respiratoire et, dans les deux modes d'empoisonnement, des solutions de sels de sulfate doivent être prêts à appliquer les premiers soins aux personnes touchées.
En cas de déversements, il doit être isolé de substances et de matériaux combustibles et, en cas de feu, vous ne devez jamais entrer en contact avec des produits chimiques secs ou des mousses. La zone doit être inondé d'eau si le feu est plus grand.
Les références
- Mabus. (s.F.). Sciencemadness. Obtenu de Sciencemadness.org
- United States Inceniary Bomb Th3-M50A3. (s.F.). Obtenu à partir de pages de munitions.com
- Cameo Chemicals. (s.F.). Obtenu de Cameochimicals.Noaa.Gouvernement
- Chemspider. (s.F.). Obtenu à partir de Chemspider.com
- « Étapes et caractéristiques des circuits productifs SOJ
- Dynamique des exemples de système de particules, exercices »

