Loi Avogadro
- 2484
- 615
- Noa Da silva
Quelle est la loi d'Avogadro?
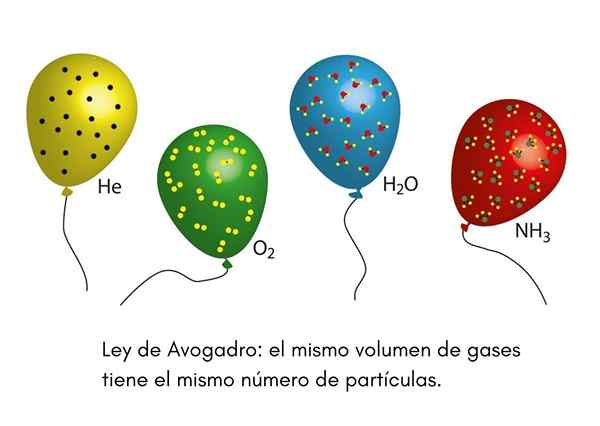
La Loi Avogadro, Également appelé principe Avogadro, c'est une loi qui s'applique aux gaz idéaux et a été énoncée par un scientifique du XIXe siècle appelé Amadeo Avogadro. Cette loi établit que deux volumes égaux de gaz différents qui sont dans les mêmes conditions de température et de pression contiennent le même nombre de particules gazeuses.
Cela signifie que, si nous avons deux ballons, l'un plein d'hélium et l'autre avec de l'oxygène, et que les deux ballons ont le même volume, la même pression et la même température, alors il y aura le même nombre d'atomes d'hélium gazeux dans le premier globe que l'oxygène molécules dans la seconde.
Formule de droit Avogadro
Une autre façon de déclarer la loi d'Avogadro est de dire que si une pression et une température constantes sont maintenues, le volume d'un gaz sera proportionnel au nombre de moles. Ceci est représenté de manière mathématique comme:
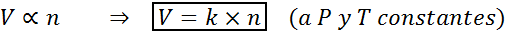
Cette formule peut être réorganisée en V / n = k, c'est-à-dire que la relation entre le volume et le nombre de moles reste constante chaque fois que p et t sont constants.
Ainsi, si nous introduisons ou supprimons une certaine quantité de gaz d'un conteneur gardant P et T constant, le volume changera et l'état initial et final sera lié au moyen de l'équation suivante:

Conditions dans lesquelles la loi d'Avogadro est remplie
Cette loi s'applique exactement aux gaz idéaux. Ce sont des gaz formés par des particules spécifiques (qui n'occupent pas un volume dans l'espace) qui n'interagissent pas entre elles.
Il peut vous servir: biodiesel: histoire, propriétés, types, avantages, inconvénientsComme son nom l'indique, ce type de gaze n'existe pas dans la réalité mais dans notre imagination. Ils sont une "idée" simplifiée de ce que nous pensons être un gaz. Cependant, il y a certaines conditions dans lesquelles un réel gaz, comme l'air, se comporte idéalement: à des pressions très basses et à des températures très élevées.
Les faibles pressions font que le volume occupé par les particules de gaz est négligeable par rapport à la taille du récipient, tandis que les températures élevées font bouger les particules si rapidement qu'elles n'ont pas le temps d'interagir lorsqu'elles se croisent les unes avec les autres.
Dans ces conditions, la plupart des gaz répondent à la loi d'Avogadro avec une bonne précision.
Importance de la loi d'Avogadro
L'une des contributions les plus importantes de la loi d'Avogadro a été qu'elle a permis de démontrer l'existence de gaz élémentaires formés par plus d'un atome comme l'O2 ou h2. Cela a contribué à l'avancée de la théorie atomique.
Además, la ley de Avogadro complementa a las leyes de los gases de Boyle, Charles y Gay-Lussac, y al combinarla con estas tres leyes, la ley de Avogadro permite derivar la ley de los gases ideales, una de las leyes más importantes en la chimie.
D'un autre côté, la loi d'Avogadro permet également d'établir des relations entre les poids moléculaires de différents gaz, car il implique que la masse de volumes égaux de différents gaz mesurés à la même température et pression, est proportionnelle à la masse de chaque particule de chaque gaz.
Peut vous servir: nitrate de sodium (nano3): structure, propriétés, utilisations, risquesAinsi, avec des échantillons de regret unique de deux gaz qui occupent des volumes égaux à la même température et pression, la relation entre ses masses molaires peut être obtenue.
Exemples de la loi d'Avogadro dans la vie quotidienne
Ballons de fête
Nous avons déjà vu un clown lors d'une fête pour enfants gonflant des ballons d'hélium pour les distribuer parmi les enfants. Ces ballons sont à peu près à la même température. Si les ballons à deux partis sont remplis à la même pression et que les deux ont la même taille, la loi d'Avogadro garantit que les deux ballons auront le même nombre de grains d'hélium.
D'un autre côté, si l'un des ballons est plus grand que l'autre, il aura un volume plus important et, selon la loi d'Avogadro, il aura une plus grande quantité de particules d'hélium à l'intérieur.
Les pneus d'une voiture
Quel que soit le gaz qu'ils sont remplis, les pneus sur les côtés opposés d'une voiture sont toujours remplis à la même pression finale d'environ 32 psi.
De plus, nous nous assurons toujours que les deux caoutchoucs sont les mêmes, donc ils auront le même volume. Ainsi, selon le principe d'Avogadro, nous pouvons dire que les deux pneus contiendront le même nombre de particules gazeuses.
Une seringue pleine d'air
Supposons que nous ayons une seringue ouverte et pleine de 50 cm3 d'air. Comme il est ouvert, l'intérieur de la seringue et de l'extérieur (l'environnement) sont à la même température et la même pression.
Supposons maintenant que nous appuyons sur le piston de seringue et le déplacons jusqu'à ce que 10 cm soient lus3. Comme la seringue est découverte, l'air s'échappe à travers la pointe à mesure que le piston se déplace, de sorte que le nombre de particules d'air à l'intérieur de la seringue diminue avec le volume.
Peut vous servir: volatilisationAu fur et à mesure que la pression ni la température ne changent, la loi Avogadro ne peut être appliquée pour relier le volume final à la quantité de particules d'air qui restent à l'intérieur de la seringue. Cette relation est:

Réorganisation de cette équation, nous obtenons cela:
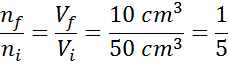
Ce résultat signifie que, si nous réduisons le volume à l'intérieur de la seringue au cinquième, en gardant P et T constant, alors le nombre de moles ou de particules présents à l'intérieur à la fin du processus sera également la cinquième partie de ce qui avait à l'origine.


