Caractéristiques de leucine, structure, fonctions, biosynthèse
- 2063
- 382
- Adrien Remy
La Leucine C'est l'un des 22 acides aminés qui constituent les protéines des organismes vivants. Cela appartient à l'un des 9 acides aminés essentiels qui ne sont pas synthétisés par le corps et doivent être consommés avec des aliments ingérés dans le régime alimentaire.
Leucina a été décrite pour la première fois en 1818 par le pharmacien et chimiste français. L. Proust, qui l'a appelé "audace d'oxyde". Plus tard, Erlenmeyer et Kunlin l'ont préparé à partir de l'acide α-benzoilamido-β-isopropilacrylique, dont la formule moléculaire est C6H13NO2NO2.
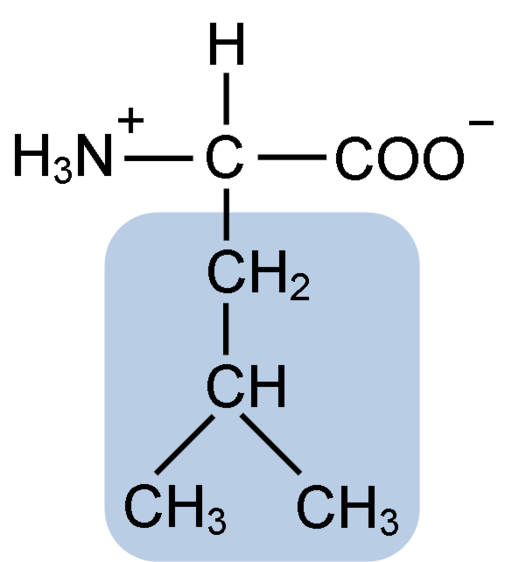
 Structure chimique de l'acide aminé de leucine (Fuene: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Structure chimique de l'acide aminé de leucine (Fuene: Clavecin [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) La leucine était essentielle lors de la découverte du sentiment de traduction des protéines, car sa structure hydrophobe a permis au biochimiste Howard dentzis de marquer radioactivement l'hydrogène du carbone 3 et d'observer la signification dans laquelle les acides aminés sont incorporés dans la synthèse peptidique de l'hémoglobine.
Les protéines connues sous le nom de «fermeture éclair» ou «fermetures» de Leucina sont, avec les «doigts de zinc», les facteurs de transcription les plus importants des organismes eucaryotes. Les fermetures à glissière de leucine sont caractérisées par leurs interactions hydrophobes avec l'ADN.
Généralement, les protéines riches en leucine ou constituées par des acides aminés ramifiées ne sont pas métabolisées dans le foie, ils vont plutôt dans les muscles où ils sont rapidement utilisés pour la synthèse des protéines et l'obtention d'énergie.
La leucine est un acide aminé de chaîne ramifiée nécessaire à la biosynthèse des protéines et des acides aminés du lait, qui sont synthétisés dans les glandes mammaires. Vous pouvez trouver de grandes quantités de cet acide aminé libre à l'intérieur du lait maternel.
Parmi tous les acides aminés qui composent les protéines, la leucine et l'arginine sont les plus abondantes et les deux ont été détectées dans les protéines de tous les royaumes qui composent l'arbre de vie.
[TOC]
Caractéristiques
La leucine est connue comme l'acide aminé essentiel de la chaîne ramifiée, il partage la structure typique avec les autres acides aminés. Cependant, il se distingue parce que sa chaîne latérale ou son groupe R a deux carbones liés, et le dernier est lié à un atome d'hydrogène et à deux groupes méthyle.
Il appartient au groupe d'acides aminés polaires sans charge, les substituants ou les groupes R de ces acides aminés sont hydrophobes et non polaires. Ces acides aminés sont le principal responsable des interactions hydrophobes intra-protéiques et ont tendance à stabiliser la structure des protéines.
Tous les acides aminés, ayant un carbone central qui est chiral (carbone α), c'est-à-dire qu'il a quatre substituants unis différents, ils peuvent être trouvés de deux manières différentes dans la nature; Ainsi, il y a d et l-leucina, ce dernier typique dans les structures protéiques.
Les deux formes de chaque acide aminé ont des propriétés différentes, participent à différentes routes métaboliques et peuvent même modifier les caractéristiques des structures dont elles font partie.
Par exemple, la leucine en L-leucina a un goût légèrement amer, tandis que sous sa forme de D-leucine, il est très sucré.
La forme de tout acide aminé est plus facile à métaboliser par le corps des mammifères. L-leucina est facilement dégradée et exploitée pour la construction et la protection des protéines.
Structure
La leucine se compose de 6 atomes de carbone. Le carbone central, commun dans tous les acides aminés, est lié à un groupe carboxyle (COOH), un groupe amino (NH2), un atome d'hydrogène (H) et une chaîne latérale ou un groupe R R composé de 4 atomes de carbone.
Peut vous servir: MesothelioLes atomes de carbone dans les acides aminés peuvent être identifiés avec des lettres grecques. La numérotation commence à partir du carbone de l'acide carboxylique (COOH), tandis que l'annotation avec l'alphabet grec commence du carbone central.
La leucine a en tant que groupe substituant dans sa chaîne R R à un groupe isobutyl ou 2-méthylpropil produit par la perte d'un atome d'hydrogène, avec la formation d'un radical alkyle; Ces groupes apparaissent comme des ramifications dans la structure des acides aminés.
Les fonctions
La leucine est un acide aminé qui peut servir de précurseur cétogène d'autres composés impliqués dans le cycle d'acide citrique. Cet acide aminé représente une source importante pour la synthèse de l'acétyl-CoA ou de l'acétoacétyl-CoA, qui font partie des voies de formation des corps cétone dans les cellules hépatiques.
On sait que la leucine est indispensable dans les voies de signalisation de l'insuline, qui participe au début de la synthèse des protéines et évite la perte de protéines due à la dégradation.
Habituellement, les structures internes des protéines sont composées d'acides aminés hydrophobes tels que la leucin, la valine, l'isoleucine et la méthodine. Ces structures sont généralement conservées pour les enzymes communes parmi les organismes vivants, comme dans le cas du cytochrome c.
La leucine peut activer les routes métaboliques dans les cellules de la glande mammaire pour stimuler la synthèse du lactose, les lipides et les protéines qui remplissent les fonctions telles que les molécules de signalisation dans la régulation de l'homéostasie énergétique des jeunes chez les mammifères.
Les domaines riches en leucine sont une partie essentielle de protéines de liaison à l'ADN spécifiques, qui sont généralement des diamètres structurels d'une manière super inscrite et qui sont appelées "protéines de fermeture éclair de leucine".
Ces protéines ont une caractéristique distinctive un modèle régulier de leucines répétées ainsi que d'autres acides aminés hydrophobes qui sont responsables de la régulation des syndicats de facteurs de transcription à l'ADN et entre différents facteurs de transcription.
Les protéines zippées de leucin peuvent former des homo ou des hétérodimères qui leur permettent.
Biosynthèse
Tous les acides aminés de chaîne ramifiés, y compris la leucine, sont principalement synthétisés dans les plantes et les bactéries. Dans les plantes à fleurs, il y a une augmentation significative de la production de leucine, car il s'agit d'un précurseur important pour tous les composés responsables de l'arôme des fleurs et des fruits.
L'un des facteurs attribués à la grande abondance de leucine dans les différents peptides bactériens est que 6 codons différents du code génétique codent pour la leucine (uua-uug-ucu-cua-cua-cug), il en va de même pour l'arginine.
La leucine est synthétisée dans des bactéries à partir d'un itinéraire à cinq étapes qui utilise comme point de départ un kétacide lié à la valine.
Ce processus est régulé à partir de manière alostérale, de sorte que lorsqu'il y a un excès de leucine à l'intérieur du cellulaire, il inhibe les enzymes qui participent à l'itinéraire et arrête la synthèse.
Peut vous servir: Index Simpson: formule, interprétation et exempleVoie biosinthétique
La biosynthèse de la leucine dans les bactéries commence par la conversion d'un kétacide dérivé de la valine, le 3-méthyl-2-oxobutanoat dans (2S) -2-isopropilmalate, grâce à l'action de l'enzyme 2-isopropilmalo synta, qui utilise l'acétyl -Coa et l'eau à cet effet.
Le (2S) -2-isopropilmalaate perd une molécule d'eau et est transformé en 2-isopropilmaleate par 3-isopropylmalate déshydratase. Par la suite, la même enzyme ajoute une autre molécule d'eau et transforme le 2-isopropilmaleato en (2R-3S) -3-isopropilm.
Ce dernier composé est soumis à une réaction d'oxydorréduction qui mérite la participation d'une molécule NAD +, qui produit la (2S) -2-isopropil-3-oxosuccination.
La (2S) -2 -osopropyl-3-oxosuccination perd un atome de carbone sous forme de CO2 spontanément, générant le 4-méthyl-2-oxopentanoate qui, par action d'une transaminase d'acides aminés à chaîne ramifiée (transaminase leucine, spécifiquement) Et avec la libération concomitante du l-glutamate et du 2-oxoglutarate, il produit de la L-leucina.
Dégradation
Le rôle principal de la leucine est d'agir comme une signalisation qui indique à la cellule qu'il y a suffisamment d'acides aminés et d'énergie pour commencer la synthèse des protéines musculaires.
La dégradation des acides aminés de la chaîne ramifiée alors que la leucine commence par une transamination. Ceci et les deux étapes enzymatiques suivantes sont catalysées par les trois enzymes dans le cas de la leucine, de l'isoleucine et de la valine.
La transamination des trois acides aminés produit les dérivés α-écotoacides de ceux-ci, qui sont soumis à une décarboxylation oxydative pour produire des thioés acyl-coa.
Pendant le catabolisme de la leucine, l'acyl-CoA correspondant, l'insatura β-insaturé (HMG-CoA), qui est intermédiaire dans la biosynthèse du cholestérol et d'autres isoprénoïdes.
Voie catabolique de Leucina
De la formation de l'oncle acyl-CoA α, insaturé β qui dérive de la leucine Les voies cataboliques de cet acide aminé et la valine et l'isoleucine divergent considérablement.
La leucina acyl-CoA UCION α, β-insaturée est traitée en aval par trois enzymes différentes appelées (1) 3-méthylcrotonyl-CoA carboxylase, (2) 3-méthylglutaconil-CoA hydratasa et (3) 3-hydroxi -3-méthylglutaril -Coa liasa.
Chez les bactéries, ces enzymes sont responsables de la conversion du 3-méthylcrotonyl-CoA (dérivé de leucine) dans le 3-méthylglutaconil-CoA, dans le 3-hydroxy-3-méthylglutaril-CoA et dans l'acétoacétate et l'acétyl-CoA, respectivement, respectivement, respectivement, dans l'acétoacétate et l'acétyl-CoA, respectivement, respectivement, dans l'acétoacétate et l'acétyl-CoA,.
La leucine disponible dans le sang est exploitée pour la synthèse des protéines musculaires / myofibrillaires (MPS). Cela agit comme un facteur d'activation de ce processus. Interagissez également directement avec l'insuline, influençant l'offre de la
Aliments riches en leucine
La consommation de riches protéines d'acides aminés est indispensable pour la physiologie cellulaire des organismes vivants et de la leucine ne fait pas exception parmi les acides aminés essentiels.
Les protéines obtenues à partir du sérum laitier sont considérées comme les plus riches dans les résidus L-leucina. Cependant, tous les aliments à haute teneur en protéines tels que le poisson, le poulet, les œufs et la viande rouge offrent de grandes quantités de leucine pour le corps.
Peut vous servir: reproduction de virus: phases et caractéristiquesLe maïs dans le grain est pauvre dans les acides aminés lysine et tryptophane, il a des structures tertiaires très rigides pour la digestion et a peu de valeur du point de vue nutritionnel, cependant, il a des niveaux élevés de leucine et d'isoleucine.
Les fruits des plantes à légumineuses sont riches en presque tous les acides aminés essentiels: lysine, treonine, isoleucine, leucine, phénylalanine et valine, mais ont peu de contenu de méthodin et de cystéine.
La leucine est extraite, purifiée et concentrée dans des comprimés sous forme de compléments alimentaires pour les athlètes de grande concurrence et est commercialisé comme un médicament. La principale source d'isolement de cet acide aminé correspond aux farines de soja.
Il existe un supplément nutritionnel utilisé par les athlètes pour la régénération musculaire connue sous le nom de BCAA (anglais "Chaîne d'acides aminés ramifiés "). Cela fournit des concentrations élevées d'acides aminés à chaîne ramifiée: leucina, la valine et l'isoleucine.
Avantages de votre apport
Les aliments riches en leucine aident à contrôler l'obésité et d'autres maladies métaboliques. De nombreux nutritionnistes soulignent que les aliments riches en leucine et les suppléments nutritionnels basés sur cet acide aminé contribuent à la régulation de l'appétit et de l'anxiété chez les adultes.
Toutes les protéines riches en leucine stimulent la synthèse des protéines musculaires; Il a été démontré qu'une augmentation de la proportion de leucine ingérée par rapport aux autres acides aminés essentiels peut inverser l'atténuation de la synthèse des protéines dans la musculature des patients âgés.
Même les personnes atteintes de troubles maculaires graves qui sont paralysés peuvent arrêter la perte de masse et de force musculaire avec la bonne supplémentation en leucine orale, en plus d'appliquer des exercices systémiques de résistance musculaire.
La leucine, la valine et l'isoleucine sont des composants essentiels de la masse qui constituent le muscle squelettique des animaux vertébrés, donc leur présence est vitale pour la synthèse de nouvelles protéines ou pour la réparation de la pré-existant.
Troubles de la carence
Les carences ou malformations du complexe α-zo-pote déshydrogénase, qui est responsable de la métabolisation de la leucine, de la valine et de l'isoleucine chez l'homme, peut provoquer de graves troubles mentaux.
De plus, il existe une condition pathologique liée au métabolisme de ces acides aminés de chaîne ramifiés appelés "maladie urinaire avec odeur de sirop d'ARCE".
À ce jour, l'existence d'effets indésirables sur la consommation excessive de leucine n'a pas été démontrée. Cependant, une dose maximale de 550 mg / kg par jour est recommandée, car il n'y a pas eu d'études à long terme liées à une exposition excessive des tissus à cet acide aminé.
Les références
- Álava, m. D. C., Camacho, m. ET., & Delgadillo, J. (2012). Santé musculaire et prévention de la sarcopénie: l'effet de la protéine, de la leucin et de la ß-hydroxy-ß-méthylbutirate. Magazine de métabolisme des os et des minéraux, dix(2), 98-102.
- Phénheme, ou. R. (1993). chimie alimentaire (Non. 664: 543). Appel.
- Massey, L. K., Sokatch, J. R., & Conrad, R. S. (1976). Catabolisme d'acide amimino à chaîne ramifiée chez les bactéries. Revues bactériologiques, 40(1), 42.
- Mathews, C. K., & Ahern, k. g. (2002). Biochimie. Pearson Education.
- Simple, un. (1999). Supplémentation en leucine et formation intensive. Médecine du sport, 27(6), 347-358.
- Munro, h. N. (Ed.). (2012). Métabolisme des protéines de mammifère (Vol. 4). Elsevier
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.

