Structure d'hydroxyde de fer (II), propriétés, utilisations
- 1634
- 125
- Lucas Schneider
Il Hydroxyde de fer (II), Également appelé hydroxyde ferreux, c'est un composé inorganique de la formule chimique de la foi (OH)2. Si sa pureté est élevée, son solide n'est composé que d'ions de foi2+ et oh- Dans une relation 2: 1; Cependant, les molécules d'eau et différentes espèces ioniques peuvent contenir, modifiant la position.
Représente la forme "réduite" de la célèbre surface rouille et rougeâtre composée d'ions de foi3+; Pendant que dans la rouille verdâtre, la foi prédomine2+, À côté de oh- et une autre quantité d'anions: CO32-, Swin42-, NON3- et haluros (f-, CL-,… ), par exemple. Le résultat, bien que la base de cette rouille verte soit la foi (OH)2, Est-ce que divers solides sont obtenus.
 Oxyde vert sur la surface du fer: matériau source de ce type d'hydroxyde. Source: Pixabay.
Oxyde vert sur la surface du fer: matériau source de ce type d'hydroxyde. Source: Pixabay. Dans la vie quotidienne, cet hydroxyde peut être envisagé dans des endroits communs. Par exemple, le navire d'image supérieur a sa surface couverte de rouille verte (pas la patine). Il y a la foi (OH)2, mais accompagné de nombreux ions des vagues de la mer.
Chimiquement parlant, les propriétés et les utilisations de ce matériau dépendent de la foi Cation2+ et de sa tendance à s'oxyder à se transformer en foi3+. C'est un agent réducteur, qui réagit rapidement avec l'oxygène dans des conditions de base. Par conséquent, il doit être utilisé dans les atmosphères inertes et les solutions acides.
[TOC]
Structure d'hydroxyde de fer (II)
Liens
En considérant uniquement la foi (OH)2 Pur, il n'y a plus rien des ions de foi2+ et oh-.
Les interactions entre elles doivent être, en théorie, de nature ionique; Chaque foi foi2+ attire deux anions oh-, dont les attractions non directionnelles finissent par établir un ordre structurel et répétitif qui définit un cristal; Cela à son tour, donne naissance à la poussière de rouille verte.
Il peut vous servir: Hydroxyde de zinc (Zn (OH) 2)Le problème est qu'il existe un certain caractère covalent entre les deux ions, et par conséquent, un lien Fe-OH ionique ne peut pas être ignoré. Compte tenu d'un lien Fe-OH partiellement ionique, on peut comprendre qu'ils sont regroupés en une sorte de couche polymère.
Doubles couches d'hydroxyde
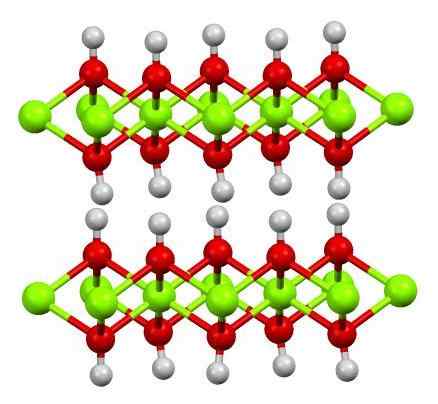
 Structure de foi (OH) 2. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Structure de foi (OH) 2. Source: Smokefoot [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] La structure de l'hydroxyde ferreux pur avec un modèle de sphères et de barres est indiquée ci-dessus. Cations fe2+ Ils sont représentés par les sphères vertes Chillón, tandis que oh anions- Pour les sphères rouges et blanches. Notez comment les ions foi sont alignés2+ Merci aux interactions (ionique-covalente) avec le OH-.
Pourquoi cette structure est-elle double couches d'hydroxydes? L'image elle-même offre la réponse: il y a deux rangées ou couches d'OH- Pour chaque foi2+; c'est-à-dire que la proportion 2: 1 de foi (OH) est maintenue2 mentionné au début.
Unités structurelles pour la foi (OH)2 Ce sont alors ces sandwichs, où les couches d'OH- Ils viendraient représenter les pains; pain chargé négativement et cela, par conséquent, ne parvient pas à réparer un cristal brun frappant.
Mais, d'un autre côté, les atomes de H s'alignent également et éclipsent les uns avec les autres. Se souvenant du concept de polarité et d'électronégativité, ces hydrogènes ont une légère charge partielle positive, δ +; qui, bien que faible, peuvent avoir une zone positive où d'autres anions ou molécules sont hébergés.
Hydrater
Quand la foi (OH)2 Il se dissout dans l'eau, ses molécules se coordonnent avec le centre de foi métallique2+ Pour former un ACU complexe: [foi (h2SOIT)4(OH)2]]. Ce complexe a une géométrie octaédrique pour avoir six ligands: quatre molécules d'eau et deux OH-. Cependant, dans l'hydroxyde ferreux, le panorama est un peu différent.
Peut vous servir: loi sur la conservation de la matièreDans Hydrate, formule hypothétique Fe (OH)2· NH2Ou, les molécules d'eau sont logées exactement entre les deux couches d'hydroxyde; c'est-à-dire qu'ils interagissent à travers des forces ioniques dipolaires avec des hydrogènes blancs ou des sphères. C'est comme si deux matchs ohfeoh avaient été saisis et que l'eau était entrecoupée pour les regrouper: ohfeoh (h2O) ohfeah.
Les molécules d'eau sont très dynamiques, empêchant les particules hydrates d'acquérir des tailles considérables et, par conséquent, de former un colloïdal ou une gelée solide.
Rouille verte et rouge
Dans les hydrates, les couches d'hydroxyde ont entrecoupé des molécules d'eau; Cependant, ils peuvent avoir d'autres anions (déjà mentionnés), provoquant une grande variété d'herbes vertes. Ils peuvent également «attraper» des molécules aussi grandes que l'ADN ou les médicaments.
Non seulement les ions foi peuvent être présents2+, Mais aussi la foi3+, Produit de l'oxydation interne causée par l'oxygène entrecoupé. Visiblement, il serait observé que la rouille verte (u oxyde) commence à devenir rougeâtre à mesure que la concentration de la foi augmente3+.
Propriétés
 Tube à essai avec hydroxyde ferreux dans l'eau. Source: Chemical Intestrest [Domaine public]
Tube à essai avec hydroxyde ferreux dans l'eau. Source: Chemical Intestrest [Domaine public] La foi (oh) est montrée ci-dessus2 précipiter dans un tube à essai. Étant dans une eau abondante, l'ACU complexe doit prédominer au-dessus de la structure nouvellement mentionnée. Notez que la surface ressemble à une couleur orange, à la suite de l'oxydation de la foi2+ à la foi3+ pour l'oxygène de l'air; C'est-à-dire que cet hydroxyde est un agent réducteur:
Foi2+ Foi3+ + et-
L'apparence physique de ce composé dans son état le plus pur est celle d'un solide brun:
 Hydroxyde ferreux pur. Source: Ondřej Mancgl [domaine public]
Hydroxyde ferreux pur. Source: Ondřej Mancgl [domaine public] Qui, en fonction de son niveau d'humidité, peut être présenté comme un solide en gelée. Il est assez insoluble dans l'eau (ksp= 8 · 10-16 et solubilité = 0,72 g / 100 ml à 25 ° C), et a une masse molaire de 89,86 g / mol et une densité de 3,4 g / ml.
Il peut vous servir: les 20 types de chimie et leur déniAucun point d'ébullition ou de fusion pour ce composé n'est signalé; Probablement en raison du fait qu'avant une source de chaleur, il se déshydrater et se transforme en oxyde ferreux, laid:
Foi (OH)2 => Moche + h2SOIT
Applications
Analyse qualitative organique
Sa puissance de réduction est utilisée pour déterminer la présence de composés nitro, RNO2. La réaction pour laquelle un test positif est obtenu est représenté avec l'équation chimique suivante:
RNO2 + 6fe (oh)2 + 4h2O => RNH2 + 6fe (oh)3
La foi (oh)3 Précipite comme un solide brun -redizo, qui certifie la présence du groupe nitro, -No2.
Réducteur de sélénium oxoanions
Le pouvoir réducteur de la foi (OH)2 Il a également utilisé pour réduire les anions SEO32- (Selenito) et SEO42- (sélénate) au sélénium élémentaire,. Pratiquement, il permet la suppression de tels anions, nocif à la santé, sous la forme d'un solide de sélénium insoluble et facilement amovible.
Matériaux à double couches
Sa structure pure et sa rouille verte sont une source d'inspiration pour la conception de nouveaux matériaux des caractéristiques minéralogiques.
On estime que la fonction de ceux-ci permet le transport d'une espèce spécifique entre ses couches, de telle manière que sa libération peut être contrôlée ou réduite au site actif (sols, cellules, surface métallique, etc.).
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). Fer (ii) hydroxyde. Récupéré de: dans.Wikipédia.org
- Centre national d'information sur la biotechnologie. (2019). Hydroxyde ferreux. Base de données PubChem. CID = 10129897. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Nick Doe. (s.F.). Tests pour les phénols et les groupes nitro. Chimie 211. Récupéré de: les universitaires.Wellesley.Édu
- Clark Jim. (27 avril 2019). Chimie du fer. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Logiciel technique de Kingston. (2019). Chimie de rouille. Médecins à la corrosion. Récupéré de: corrosion-dootors.org
- Zingaro, ralph a. et al. (1997). Réduction des anions oxoselélénium par l'hydroxyde de fer (II). Environnement International. 23 (3): 299-304. Doi: 10.1016 / S0160-4120 (97) 00032-9
- « Propriétés d'oxyde de chlore (V), structure, utilisations
- Propriétés d'oxyde de chlore (III), structure, utilisations »

