Propriétés d'oxyde de chlore (V), structure, utilisations

- 3320
- 749
- Raphaël Meyer
Il Oxyde de chlore (V) C'est un composé inorganique très instable dont la formule chimique est CL2SOIT5. C'est l'un des nombreux oxydes de chlore, qui se caractérisent par des espèces moléculaires, voire radicales.
Le CL2SOIT5 Il n'a trouvé que la vie sur papier et les calculs théoriques; Cependant, son existence n'a pas été exclue et il est probable que certains puissent être caractérisés (par des techniques de spectroscopie avancée)). Ce qui est dû aux concepts généraux de chimie peut être prédit de cet oxyde, c'est qu'il s'agit de l'anhydride de l'acide chlorique, HCLO3.
 Molécule CL2O5. Source: Jynto [CC0].
Molécule CL2O5. Source: Jynto [CC0]. La molécule hypothétique d'oxyde de chlore (V) est indiquée ci-dessus (V). Notez que parce que c'est une molécule, la présence du Cl+5; Encore moins quand il doit avoir une puissance aussi polarisante pour forcer l'oxygène, reliant de manière covalente.
Comme tout composé instable, il libère de l'énergie pour se décomposer dans des produits plus stables; processus qui, dans de nombreux cas, est explosif. Quand le CL2SOIT5 Il décompose la liberté2 je2. Il est théorisé que dans l'eau, selon l'isomère de Cl2SOIT5, Plusieurs oxoacides de chlore peuvent être formés.
[TOC]
Propriétés
La masse molaire du CL2SOIT5 est 150 9030 g / mol. De cette masse et de sa molécule hypothétique, il peut être conjecturé que s'il peut être isolé, ce serait probablement un liquide huileux; Bien sûr, en le comparant à l'apparence physique du CL2SOIT7.
Bien qu'il ne puisse pas être isolé ou caractérisé, cet oxyde de chlore est acide, covalent et doit également avoir un petit moment dipolaire. Son acidité est compréhensible si l'équation chimique de son hydrolyse est analysée:
Peut vous servir: loi Amagat: explication, exemples, exercicesCL2SOIT5 + H2Ou 2hclo3
Être le HCLO3 L'acide chlorique. La réaction inverse entraînerait le cas que l'acide peut être déshydraté:
2hclo3 => CL2SOIT5 + H2SOIT
D'un autre côté, quand le cl2SOIT5 Dès qu'il se produit, il se décompose:
2Cl2SOIT5 => 4clo2 + SOIT2
C'est donc une espèce intermédiaire au lieu d'un oxyde qui parle correctement. Sa décomposition doit être si rapide (étant donné que le CL est même formé2SOIT5), qui n'a pas pu être détecté par les techniques d'analyse instrumentale actuelles.
Structure d'oxyde de chlore (V)
Molécule
Dans l'image supérieure, la structure de la molécule CL hypothétique a été montrée2SOIT5 Avec un modèle de sphères et de barres. Les sphères rouges représentent les atomes d'oxygène et le chlore vert au chlore. Chaque chlore a un environnement pyramide trigonal, donc son hybridation doit être SP3.
Ainsi, la molécule CL2SOIT5 Il peut être considéré comme deux pyramides trigonales liées par un oxygène. Mais s'il est soigneusement observé, une pyramide guide ses atomes d'oxygène et l'autre hors de l'avion (en direction du lecteur).
De là, il est présumé qu'il y a des rotations dans le lien ou2CL-O-CL2, Rendre la molécule relativement dynamique. Notez que la formule ou2Cloclo2 C'est un moyen de représenter la structure du CL2SOIT5.
Structure de Lewis
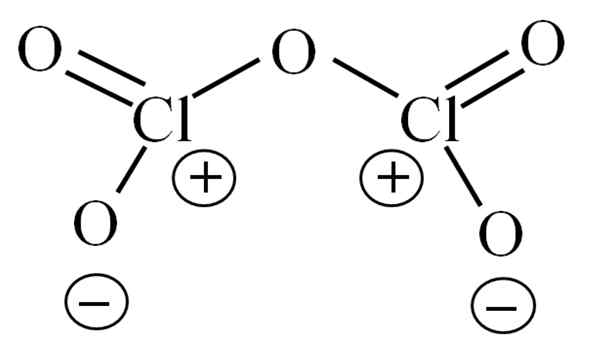 Structure de Lewis pour l'hypothétique Cl2O5. Source: Gabriel Bolívar.
Structure de Lewis pour l'hypothétique Cl2O5. Source: Gabriel Bolívar. Jusqu'à présent, la molécule elle-même n'a pas permis de déchiffrer à ce que son instabilité est dû. Pour faire la lumière à cette question, sa structure Lewis est utilisée, représentée ci-dessus. Notez qu'il peut être à tort que la structure est plate, mais dans la section antérieure, il a été précisé que ce n'est pas le cas.
Peut vous servir: Azid de sodium (NAN3): structure, propriétés, utilisations, risquesPourquoi les deux atomes de chlore ont des charges formelles positives? Parce que le chlore a une paire sans électrons, ce qui peut être vérifié lorsque la théorie de la liaison Valencia est appliquée (qui en raison de la simplification ne sera pas effectuée ici). Ainsi, sa charge formelle est:
CF = 7 - (4 + 2) = 1
Et qu'est-ce que cela a à voir avec votre instabilité? Eh bien, le chlore est considérablement électronégatif, et donc un mauvais porteur de charges formelles positives. Cela revient au CL2SOIT5 Une espèce extrêmement acide, car elle doit gagner des électrons pour fournir la demande électronique des deux chloros.
L'inverse se produit avec le br2SOIT5 Et le i2SOIT5, oxydes qui existent dans des conditions normales. En effet, le brome et l'iode sont moins électronégatifs que le chlore; Et donc, ils soutiennent mieux la charge formelle positive.
Isomères et leur hydrolyse respective
Jusqu'à présent, toute l'explication est tombée à l'un des deux isomères du CL2SOIT5: Le o2Cloclo2. Qui est l'autre? Le o3Cloclo. Dans cet isomère, les chloros manquent de charges formelles positives et devraient donc être une molécule plus stable. Cependant, à la fois2Cloclo2 comme le o3Le cloclo devrait subir des réactions d'hydrolyse:
SOIT2CL-O-CL2 + H2O => 2e2CL-OH (qui ne sont rien de plus que le HCLO3)
SOIT3CL-O-CLO + H2O => O3CL-OH (HCLO4) + Ho-co (hclo2)
Notez que jusqu'à trois oxoacides de chlore peuvent être formés: HCLO3, Hclo4 Et hclo2
Nomenclature
Son nom «oxyde de chlore (v)» correspond à l'attribution selon la nomenclature des stocks. Le CL2SOIT5 Il peut également avoir deux autres noms: dicloro et pentaoxyde d'anhydride coiffant, assigné respectivement par des nomenclatures systématiques et traditionnelles.
Peut vous servir: titane: histoire, structure, propriétés, réactions, utilisationsApplications
Plus que de motiver les études informatiques, le CL2SOIT5 Il manquera d'utiliser jusqu'à ce qu'il soit découvert, isolé, caractérisé, stocké et a montré qu'il n'explose pas au moindre contact.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Sandra Luján Quiroga et Luis José Perissinotti. (2011). Oxoacides du chlore et structure des oxydes de dichlore. Chem. Educator, Vol. 16.
- Formulation chimique. (2019). Oxyde de chlore (V). Récupéré de: Formulation Quimica.com
- Linus Pauling. (1988). Chimie générale. Dover Publications, Inc., New York.
- Richard C. Ropp. (2013). Encyclopédie des composés terrestres alcalins. Elsevier.
- « Contexte et caractéristiques du néolamarckisme
- Structure d'hydroxyde de fer (II), propriétés, utilisations »

