Concept d'hybridation du carbone, types et leurs caractéristiques
- 4000
- 361
- Raphaël Charles
La hybridation du carbone Cela implique la combinaison de deux orbitales atomiques pures pour former une nouvelle orbitale moléculaire "hybride" avec ses propres caractéristiques. La notion d'orbital atomique donne une meilleure explication que le concept précédent d'orbite, pour établir une approximation de l'endroit où il y a plus de chances de trouver un électron dans un atome.
En d'autres termes, une orbitale atomique est la représentation de la mécanique quantique pour donner une idée de la position d'un électron ou d'une paire d'électrons dans une zone donnée dans l'atome, où chaque orbitale est définie en fonction des valeurs de ses nombres quantum.

Les nombres quantiques décrivent l'état d'un système (comme l'électron à l'intérieur de l'atome) à un certain moment, par l'énergie appartenant à l'électron (n), le moment angulaire décrivant dans son mouvement (L), le moment magnétique connexe (M) et le tour d'électrons tout en se déplaçant à l'intérieur du (s) atome (s).
Ces paramètres sont uniques pour chaque électron dans une orbitale, donc deux électrons ne peuvent pas avoir exactement les mêmes valeurs des quatre nombres quantiques et chaque orbitale peut être occupée par deux électrons dans la plupart des électrons.
[TOC]
Qu'est-ce que l'hybridation du carbone?
Pour décrire l'hybridation du carbone, il convient de tenir compte des caractéristiques de chaque orbitale (sa forme, son énergie, sa taille, etc.) dépendre de la configuration électronique de chaque atome.
C'est-à-dire que les caractéristiques de chaque orbitale dépendent de la disposition des électrons dans chaque «couche» ou niveau: du plus proche du noyau au plus externe, également connu sous le nom de couche de valence.
Peut vous servir: sodium: histoire, structure, propriétés, risques et utilisationsLes électrons de niveau les plus externes sont les seuls disponibles pour former un lien. Par conséquent, lorsqu'une liaison chimique se forme entre deux atomes, le chevauchement ou le chevauchement de deux orbitales (une de chaque atome) est généré et cela est étroitement lié à la géométrie des molécules.
Comme indiqué ci-dessus, chaque orbitale peut être remplie d'un maximum de deux électrons, mais le principe d'Aufbau doit échantillonner ci-dessous:

De cette façon, le premier niveau 1 est remplis, Puis 2s, suivi par 2p Et ainsi de suite, selon le nombre d'électrons que l'atome ou l'ion.
Ainsi, l'hybridation est un phénomène correspondant aux molécules, car chaque atome ne peut contribuer que des orbitales atomiques pures (s, p, d, F) et, en raison de la combinaison de deux orbitales atomiques ou plus, la même quantité d'orbitales hybrides qui permettent aux liens entre les éléments se forment.
Types d'hybridation
Les orbitales atomiques ont des formes et des orientations spatiales différentes, augmentant de complexité, comme indiqué ci-dessous:
Il est observé qu'il n'y a qu'un seul type d'orbital s (forme sphérique), trois types d'orbitaux p (forme lobulaire, où chaque lobe est orienté sur un axe d'espace), cinq types d'orbitaux d et sept types d'orbitaux F, où chaque type d'orbital a exactement la même énergie que ceux de sa classe.
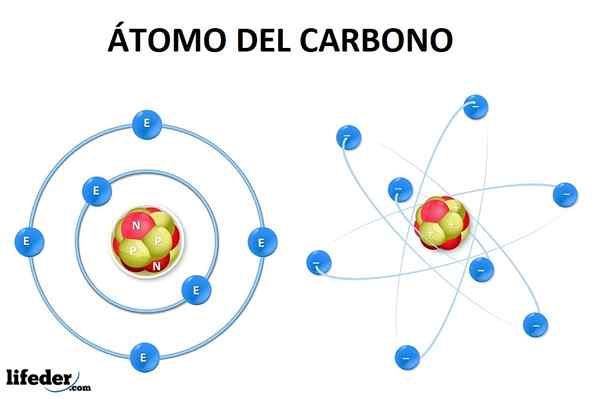
L'atome de carbone dans son état fondamental a six électrons, dont la configuration est 1s22s22p2. C'est-à-dire qu'ils devraient occuper le niveau 1s (deux électrons), le 2s (deux électrons) et en partie le 2p (les deux électrons restants) selon le principe d'Aufbau.
Peut vous servir: alotropieCela signifie que l'atome de carbone n'a que deux électrons manquants dans l'orbital 2p, Mais il n'est pas possible d'expliquer la formation ou la géométrie de la molécule de méthane (ch4) ou autre plus complexe.
Donc, pour former ces liens, l'hybridation des orbitales est nécessaire s et p (Dans le cas du carbone), pour générer de nouvelles orbitales hybrides qui expliquent même les liaisons doubles et triples, où les électrons acquièrent la configuration la plus stable pour la formation de molécules.
Sp3
L'hybridation sp3 Il se compose de la formation de quatre orbitales "hybrides" des orbitales 2S, 2PX, 2 Pet et 2pz Pur.
Ainsi, il y a la réarrose des électrons au niveau 2, où il y a quatre électrons disponibles pour la formation de quatre liaisons et sont ordonnés en parallèle pour avoir moins d'énergie (plus grande stabilité).
Un exemple est la molécule d'éthylène (C2H4), dont les liens forment des angles de 120 ° entre les atomes et fournissent une géométrie trigonale plate.
Dans ce cas, des liens C-H et C-C simples sont générés (en raison des orbitales sp2) et une double liaison C-C (en raison de l'orbitale p), Pour former la molécule la plus stable.

Sp2
Par l'hybridation SP2 Trois orbitales «hybrides» sont générées à partir d'orbitale pure 2S. De plus, une orbitale p pure qui participe à la formation d'une double liaison (appelée pi: "π") est obtenue.
Un exemple est la molécule d'éthylène (C2H4), dont les liens forment des angles de 120 ° entre les atomes et fournissent une géométrie trigonale plate. Dans ce cas, des liens C-H et C-C simples sont générés (en raison des orbitales SP2) et une double liaison C-C (en raison de l'orbital p), pour former la molécule la plus stable.
Peut vous servir: réactions chimiques: caractéristiques, pièces, types, exemples Sp
Sp
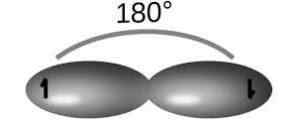
Grâce à l'hybridation SP. De cette façon, ils forment deux orbitales pures qui participent à la formation d'un triple lien.
Pour ce type d'hybridation, la molécule d'acétylène (C2H2), dont les liens forment des angles de 180 ° entre les atomes et fournissent une géométrie linéaire.
Pour cette structure, il existe de simples liens C-H et C-C (en raison des Orbitals SP) et une liaison triple C-C (c'est-à-dire deux liaisons PI en raison des orbitales P), pour obtenir la configuration avec moins de répulsion électronique.

Les références
- Hybridation orbitale. Récupéré de.Wikipédia.org
- Fox, m. POUR., Et Whitsell, J. K. (2004). Chimie organique. Récupéré des livres.Google.co.aller
- Carey, F. POUR., et Sundberg, R. J. (2000). Chimie organique avancée: Partie A: Structure et mécanismes. Récupéré des livres.Google.co.aller
- Anslyn, e. V., Et Dougherty, D. POUR. (2006). Chimie organique physique moderne. Récupéré des livres.Google.co.aller
- Mathur, R. B.; Singh, b. P., Et panda, s. (2016). Nanomatériaux de carbone: synthèse, structure, propriétés et applications. Récupéré des livres.Google.co.aller
- « Caractéristiques, types et exemples de porosité chimique
- Caractéristiques du niveau morphosyntaxique et ressources littéraires (exemples) »

