Structure du fluorure de calcium (CAF2), propriétés, utilisations

- 2237
- 447
- Jade Duval
Il fluorure de calcium Il s'agit d'un solide inorganique formé par un atome de calcium (CA) et deux atomes de fluor (F). Sa formule chimique est CAF2 Et c'est un solide blanc gris cristallin.
Dans la nature, il se trouve dans le minerai de fluorite ou les éclaboussures du fluor. Il existe naturellement dans les os et les dents. Le minéral de fluorite est la principale source utilisée pour obtenir d'autres composés de fluor.
 CAF Fluorure de calcium2 solide. W: Utilisateur: Walkerma en juin 2005. Source: Wikimedia Commons.
CAF Fluorure de calcium2 solide. W: Utilisateur: Walkerma en juin 2005. Source: Wikimedia Commons. De plus, le café2 Il est utilisé pour la prévention des caries dans les dents, il est donc ajouté aux matériaux utilisés par les dentistes pour les guérir. En fait, le fluorure de calcium est également ajouté à l'eau potable (eau qui peut être bu) afin que la population profite lors de l'ingestion et du brossage des dents.
Caf2 Il est utilisé dans les grands cristaux dans l'équipement optique et les caméras. Il est également utilisé dans de petits appareils qui servent à détecter la quantité d'une personne exposée à la radioactivité.
[TOC]
Structure
CAF Fluorure de calcium2 C'est un composé ionique formé par un cation calcique2+ et deux flexités de fluor-. Cependant, certaines sources d'informations indiquent que leurs liens ont un certain caractère covalent.
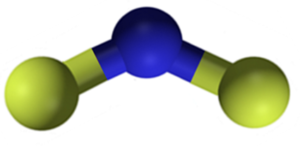 Structure du fluorure de calcium CAF2. Bleu: calcium; Fluor jaune. Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Structure du fluorure de calcium CAF2. Bleu: calcium; Fluor jaune. Claudio Pistilli [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Nomenclature
Fluorure de calcium
Propriétés
État physique
Coloriage solide à blanc grisâtre avec structure cristalline cubique.
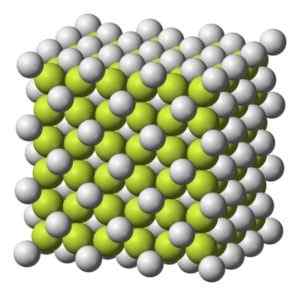 Structure cristalline cubique du café2. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structure cristalline cubique du café2. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Poids moléculaire
78,07 g / mol
Point de fusion
1418 ºC
Point d'ébullition
2533 ºC
Densité
3,18 g / cm3 à 20 ° C.
Indice de réfraction
14328
Solubilité
Il est insoluble dans l'eau à 20 ° C. Presque insoluble à 25 ° C: 0,002 g / 100 ml d'eau. Légèrement soluble.
Propriétés chimiques
Ses propriétés oxydantes ou réducteurs sont très faibles, cependant, ces réactions peuvent se produire. Bien que, généralement, dans très peu de cas.
Il est inerte aux composés chimiques organiques et à de nombreux acides, y compris l'acide fluorhorique HF. Il se dissout lentement dans l'acide nitrique3.
Peut vous servir: Expérience Millikan: procédure, explication, importanceCe n'est pas inflammable. Ne réagit pas rapidement avec de l'air ou de l'eau.
En raison de sa petite affinité pour l'eau, bien qu'elle soit exposée à un pourcentage élevé d'humidité, il ne l'affecte pas même pendant un mois à température ambiante normale.
En présence d'humidité, les parois de leurs cristaux sont lentement dissous à des températures supérieures à 600 ° C. Dans les environnements secs, il peut être utilisé jusqu'à environ 1000 ° C sans affecter sensiblement.
Présence dans la nature
CAF Fluorure de calcium2 Il se trouve naturellement dans le minerai de fluorite ou les éclaboussures de fluorure.
Bien que le café2 Pure est incolore, le minéral fluorite est souvent coloré par la présence d'électrons piégés dans les "trous" de la structure cristalline.
Ce minéral est très apprécié pour sa luminosité vitreuse et sa variété de couleurs (violet, bleu, vert, jaune, incolore, marron, rose, noir et orange rougeâtre). On dit que c'est "le minéral le plus coloré du monde".
 Fluorite d'une mine en France. Toulouse Museum [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Fluorite d'une mine en France. Toulouse Museum [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Fluorite (cristaux bleus) du musée naturel de Milan. Giovanni dall'orto [cc by-sa 2.5 it (https: // crerivecommons.Org / licences / by-sa / 2.5 / it / acte.dans)]. Source: Wikimedia Commons.
Fluorite (cristaux bleus) du musée naturel de Milan. Giovanni dall'orto [cc by-sa 2.5 it (https: // crerivecommons.Org / licences / by-sa / 2.5 / it / acte.dans)]. Source: Wikimedia Commons. Fluorite d'une mine en Angleterre. Didier Descuens [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Fluorite d'une mine en Angleterre. Didier Descuens [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Fluorite d'une mine en France. Didier Descuens [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Fluorite d'une mine en France. Didier Descuens [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
 Fluorite d'une mine aux États-Unis. Auteur: Oliveira Jurema. Source: Wikimedia Commons.
Fluorite d'une mine aux États-Unis. Auteur: Oliveira Jurema. Source: Wikimedia Commons. Le fluorure de calcium se trouve également dans les os en quantités comprises entre 0,2 et 0,65%, et également dans l'émail des dents dans 0,33-0,59%.
Applications
- Dans l'obtention de composés de fluor
Fluorita Caf2 C'est la source de base ou majoritaire de fluor dans le monde entier. C'est la matière première pour préparer presque tous les composés fluor.
Le plus important d'entre eux est l'acide hf fluorhorhorique, à partir de laquelle les autres composés à fluctuation sont préparés. L'ion fluorure f- Il est libéré du minéral par réaction de cela avec l'acide sulfurique concentré H2Swin4:
Peut vous servir: IsomériaCaf2 (solide) + H2Swin4 (liquide) → Cas4 (solide) + 2 hf (gaz)
- Dans les soins de dents
CAF Fluorure de calcium2 C'est un agent pour la prévention des caries. Il est utilisé pour fluoriser les eaux buvables (eaux qui peuvent boire) dans l'objectif de cet objectif.
De plus, les faibles concentrations de fluorure f- (de l'ordre de 0,1 parties par million) qui sont utilisés dans les pâtes dentifriques et les bains de bouche ont montré un effet positif profond sur les soins dentaires préventifs des caries.
 Le fluorure de calcium aide à la prévention des caries. Auteur: Annalise Batista. Source: Pixabay.
Le fluorure de calcium aide à la prévention des caries. Auteur: Annalise Batista. Source: Pixabay. Nanoparticules de CAF2 plus efficace
Bien que les fluorures soient utilisés dans les pâtes dentaires et le rinçage, la faible concentration de calcium (CA) dans la salive fait que les dépôts de café ne se forment pas2 dans les dents de la manière la plus efficace possible.
C'est pourquoi un moyen d'obtenir la poussière de café a été conçu2 comme nanoparticules.
Pour cela, un sèche-linge est utilisé par Rocío (de l'anglais De séchage par pulvérisation) Où deux solutions (une de l'hydroxyde de calcium Ca (OH)2 et un du fluorure d'ammonium NH4F) Ils se mélangent pendant qu'ils sont pulvérisés dans une caméra avec un flux d'air chaud.
Ensuite, la réaction suivante se produit:
Ca (oh)2 + NH4F → CAF2 (solide) + NH4Oh
Le NH4Oh se volatilise comme NH3 et h2O et les nanoparticules de CAF restent2.
Ceux-ci ont une réactivité élevée et une plus grande solubilité, ce qui les rend plus efficaces pour la séinéralisation des dents et en tant qu'annemies.
- Dans l'objectif pour l'équipement optique
Le fluorure de calcium est utilisé pour construire des éléments optiques tels que les prismes et les spectrophotomètres de lumière infrarouge et ultraviolette (UV).
Ces appareils permettent de mesurer la quantité de lumière absorbée par un matériau lorsqu'il le traverse.
Caf2 Il est transparent dans ces régions du spectre de la lumière, a un indice de réfraction extrêmement faible et permet d'obtenir une résolution plus efficace que celle de NaCl dans l'intervalle 1500-4000 cm-1.
Peut vous servir: paramagnétismeGrâce à sa stabilité chimique peut supporter des conditions défavorables afin que les éléments optiques de CAF2 Ils ne sont pas attaqués. Il a également une dureté élevée.
Dans les caméras
Certains fabricants de caméras utilisent des lentilles de café2 cristallisé artificiel pour réduire la dispersion de la lumière et obtenir une excellente correction de la distorsion des couleurs.
 Certaines caméras ont des lentilles de fluorure de calcium CAF2 Pour réduire la distorsion des couleurs. Bill Ebbesen [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons.
Certaines caméras ont des lentilles de fluorure de calcium CAF2 Pour réduire la distorsion des couleurs. Bill Ebbesen [CC par 3.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons. - Dans l'industrie métallurgique
Caf2 Il est utilisé comme agent fondateur dans l'industrie métallurgique, car il est une source d'insolubles en calcium dans l'eau et donc efficace dans les applications sensibles à l'oxygène.
Il est utilisé pour faire fondre et traiter le fer et l'acier. Ceci est basé sur le fait qu'il a un point de fusion similaire à celui du fer et aussi qu'il peut dissoudre les oxydes et les métaux.
- Dans les détecteurs de radioactivité ou les rayonnements dangereux
Caf2 C'est un matériau thermoluminescent. Cela signifie qu'il peut absorber le rayonnement dans les électrons de sa structure cristalline, puis lorsqu'il est chauffé pour le libérer sous forme de lumière.
Cette lumière émise peut être mesurée par un signal électrique. Ce signal est proportionnel à la quantité de rayonnement reçue par le matériau. Signifie que plus la quantité de rayonnement est élevée, plus la quantité de lumière qui sera émise plus tard lorsqu'elle sera chauffée.
Par conséquent le CAF2 Il est utilisé dans les deuximètres personnels SO appelés, qui sont utilisés par des personnes exposées à des rayonnements dangereux et vous voulez savoir combien de radiations ils ont reçues dans un certain temps.
- Autres utilisations
- Il est utilisé comme catalyseur dans les réactions chimiques de déshydratation et de déshydrogénation pour la synthèse des composés organiques.
- Il est utilisé dans les électrodes alcalines de soudage. Un soudage plus fort est obtenu qu'avec des électrodes acides. Ces électrodes sont utiles dans la fabrication de navires et de conteneurs en acier à haute pression.
- Comme un supplément de nourriture en quantités extrêmement faibles (ppm ou pièces par million).
 Soudage de l'homme. Électrodes avec café de fluor de calcium2 Ils forment des soudures plus fortes. William M. Plaque JR. [Domaine public]. Source: Wikimedia Commons.
Soudage de l'homme. Électrodes avec café de fluor de calcium2 Ils forment des soudures plus fortes. William M. Plaque JR. [Domaine public]. Source: Wikimedia Commons. Les références
- Pirmradian, m. et hooshmand, t. (2019). Reminéralisation et capacités antibactériennes des nanocomposites dentaires à base de résine. Synthèse et caractérisation du fluorure de calcium (CAF2). Dans les applications des matériaux nanocomposites en dentisterie. Récupéré de ScienceDirect.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Calcium au fluor. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Weman, K. (2012). Soudage manuel de l'arc métallique (MMA) avec électrodes enrobées. Dans le manuel des processus de soudage (deuxième édition). Récupéré de ScienceDirect.com.
- Hanning, m. et Hanning, C. (2013). Nanobiomatériaux en dentisterie préventive. Calcium au fluorure nanosise. En nanobiomatériaux en dentisterie clinique. Récupéré de ScienceDirect.com.
- Ropp, r.C. (2013). Groupe 17 (H, F, Cl, Br, I) Composés de la Terre alcaline. Calcium au fluor. Dans l'encyclopédie des composés terrestres alcalins. Récupéré de ScienceDirect.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Valkovic, V. (2000). Mesures de la radioactivité. En radioactivité dans l'environnement. Détecteurs théuminescents (TLD). Récupéré de ScienceDirect.com.
- « Nitruro de Boro (BN) Structure, propriétés, obtention, utilisations
- Structure d'oxyde de silicium (SiO2), propriétés, utilisations, obtention »

