Structure d'oxyde de silicium (SiO2), propriétés, utilisations, obtention

- 3347
- 45
- Noa Da silva
Il oxyde de silicium C'est un solide inorganique formé par l'union d'un atome de silicium et de deux oxygène. Sa formule chimique est sio2. Ce composé naturel est également appelé silicium ou dioxyde de silicium.
Le sio2 C'est le minéral le plus abondant de la croûte terrestre, car le sable est composé de silice. Selon sa structure, la silice peut être cristalline ou amorphe. Il est insoluble dans l'eau, mais se dissout dans les alcalis et dans l'acide fluorhorique HF.
 Le sable est une source de dioxyde de silicium sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Le sable est une source de dioxyde de silicium sio2. ರವಿಮುಂ [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. Le sio2 Il est également présent dans la structure de certaines plantes, bactéries et champignons. Également dans les squelettes d'organismes marins. En plus du sable, il existe également d'autres types de pierres qui sont de la silice.
La silice a une utilisation très répandue remplissant une variété de fonctions. L'utilisation la plus répandue est le matériau de filtrage des liquides tels que les huiles et les produits à l'huile, les boissons telles que la bière et le vin, ainsi que les jus de fruits.
Mais il a de nombreuses autres applications. L'un des plus utiles et les plus importants est la fabrication de verre bioactif, qui permettent un «échafaudage» où les cellules osseuses se développent pour produire des pièces osseuses manquantes en raison d'un accident ou d'une maladie.
[TOC]
Structure
Silicio sio dioxyde2 Il s'agit d'une molécule à trois atomes, dans laquelle l'atome de silicium est lié à deux atomes d'oxygène avec des liaisons covalentes.
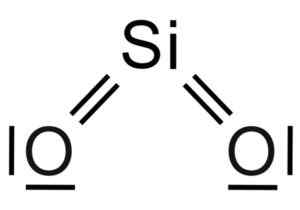 Structure chimique de la molécule SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons.
Structure chimique de la molécule SIO2. Grasso Luigi [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikimedia Commons. L'unité structurelle de la silice solide en tant que telle est un tétraèdre où un atome de silicium est entouré de 4 atomes d'oxygène.
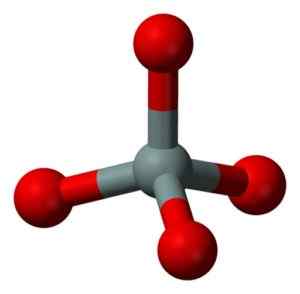 Unité structurelle de silice solide: gris = silicium, rouge = oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Unité structurelle de silice solide: gris = silicium, rouge = oxygène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Les tétraèdres se lient les uns aux autres partageant les atomes d'oxygène de leurs sommets contigus.
C'est pourquoi un atome de silicium partage dans la moitié de chacun des 4 atomes d'oxygène et cela explique le rapport dans le composé de 1 atome de silicium à 2 atomes d'oxygène (Sio2).
 Les tétraèdres partagent l'oxygène dans le SIO2. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Les tétraèdres partagent l'oxygène dans le SIO2. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Composés Sio2 Ils sont divisés en deux groupes: la silice cristalline et la silice amorphe.
Les composés de silice cristalline ont des structures avec des schémas répétitifs de silicium et d'oxygène.
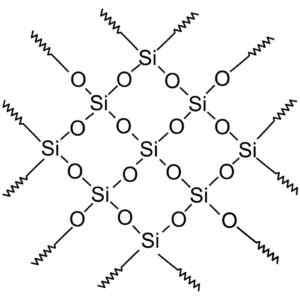 La silice cristalline a des unités répétitives. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: Polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.gnou.Org / copyleft / fdl.html)]. Source: Wikimedia Commons.
La silice cristalline a des unités répétitives. Wersję rastrową wykonał użytkownik polskiego projektu wikipedii: Polyimerek, zwektoryzował: krzysztof zajączkowski [gfdl (http: // www.gnou.Org / copyleft / fdl.html)]. Source: Wikimedia Commons. Tout le cristal de silice peut être considéré comme une molécule géante où le réseau cristallin est très fort. Les tétraèdres peuvent être liés de diverses manières, donnant naissance à diverses formes cristallines.
Peut vous servir: réseaux bravais: concept, caractéristiques, exemples, exercicesDans la silice amorphe, les structures sont liées au hasard, sans suivre un schéma régulier entre les molécules et ceux-ci sont dans une relation spatiale différente les unes avec les autres.
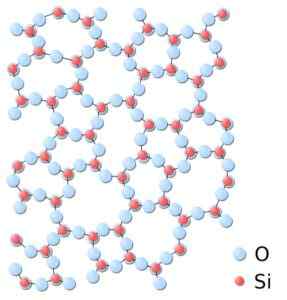 Dans la silice amorphe, les syndicats ne sont pas répétitifs ou uniformes. Silice.SVG: * Silice.JPG: Dans: Utilisateur: JDrewittderiveVative Work: Matt [Domaine public]. Source: Wikimedia Commons.
Dans la silice amorphe, les syndicats ne sont pas répétitifs ou uniformes. Silice.SVG: * Silice.JPG: Dans: Utilisateur: JDrewittderiveVative Work: Matt [Domaine public]. Source: Wikimedia Commons. Nomenclature
-Oxyde de silicium
-Dioxyde de silicone
-Silice
-Quartz
-Tridimita
-Cristobalita
-Dioxosilano
Propriétés
État physique
Couleur incolore à gris.
 Échantillon SIO2 pur. Lhchem [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Échantillon SIO2 pur. Lhchem [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Poids moléculaire
60 084 g / mol
Point de fusion
1713 ºC
Point d'ébullition
2230 ºC
Densité
2,17-2,32 g / cm3
Solubilité
Insoluble dans l'eau. La silice amorphe est soluble dans les alcalis, surtout s'il est finement divisé. Soluble dans l'acide fluorhorhorique HF.
La silice amorphe est moins hydrophile, c'est-à-dire moins liée à l'eau que le cristallin.
Propriétés chimiques
Le sio2 o La silice est essentiellement inerte pour la plupart des substances, elle est très peu réactive.
Résiste à l'attaque du chlore CL2, Bromo br2, Hydrogène h2 et de la plupart des acides à température ambiante ou légèrement plus élevé. Est attaqué par le fluor f2, HF Acide fluorhorhorique et alcalis tels que le carbonate de sodium2CO3.
Le sio2 Il peut être combiné avec des éléments métalliques et des oxydes pour former des silicates. Si la silice fondait avec des carbonates métalliques alcalins à environ 1300 ° C, les silicates alcalins sont obtenus et CO2.
Ce n'est pas du carburant. Il a une faible conductivité thermique.
Présence dans la nature
La principale source de silice dans la nature est le sable.
Le sio2 o La silice est sous la forme de trois variétés cristallines: quartz (le plus stable), tridimita et Cristobalita. Amorphes pour la silice sont les Agata, le Jaspe et le Ónice. L'opale est une silice hydratée amorphe.
Il y a aussi la silice biogénique si appelée, c'est-à-dire celle générée par les organismes vivants. Les sources de ce type de silice sont des bactéries, des champignons, des diatomées, des éponges de mer et des plantes.
Les parties brillantes et dures du bambou et de la paille contiennent de la silice, et les squelettes de certains organismes marins ont également une grande proportion de silice; Cependant, les plus importants sont les diatomateurs.
Les terres de la diatomea sont des produits géologiques des organismes unicellulaires en décomposition (algues).
Peut vous servir: poussière cosmiqueAutres types de silice naturelle
De nature, il existe également les variétés suivantes:
- Silicains vitreous qui sont du verre volcanique
- Les milléritas qui sont du verre naturel produit par la fusion de matériaux siliceux sous l'impact des météorites
- La silice fondu qui est une silice chauffée à la phase liquide et refroidie sans permettre un cristalline
Obtention
La silice des arènes est obtenue directement à partir des carrières.
 Arena Quarry en Californie. Puffle à crème de smoking [CC0]. Source: Wikimedia Commons.
Arena Quarry en Californie. Puffle à crème de smoking [CC0]. Source: Wikimedia Commons. La diatomite ou les diatomées sont également obtenues de cette manière, en utilisant des excavateurs et des équipements similaires.
La silice amorphe est préparée sur la base de solutions aqueuses de silicate métallique alcaline (comme le NA de sodium) par neutralisation avec de l'acide, comme l'acide sulfurique H2Swin4, Acide chlorhydrique HCL ou dioxyde de carbone2.
Si le pH final de la solution est neutre ou alcalin, la silice précipitée est obtenue. Si le pH est acide, la silice en gel est obtenue.
La silice pyrogénique est préparée par combustion d'un composé de silicium volatile, généralement du tétrachlorure de silicium sicl4. La silice précipitée est obtenue à partir d'une solution aqueuse de silicates à laquelle l'acide est ajouté.
La silice colloïdale est une dispersion stable de particules colloïdales de silice amorphe dans une solution aqueuse.
Applications
Dans plusieurs applications
Silice ou sio2 Il a une grande variété de fonctions, par exemple, il sert d'abrasif, absorbant, antiaapelmazante, bourré, opacifiant et pour favoriser la suspension d'autres substances, entre de nombreux autres modes d'emploi.
Il est utilisé par exemple:
-Dans la fabrication de verre en verre, en céramique, réfractaire, abrasive et soluble
-Décoloration et purification des huiles et des produits pétroliers
-Dans les moules pour la fonderie
-En tant qu'antiapelmazante de poudres de toutes sortes
-Comme antipumant
-Pour filtrer les liquides tels que les solvants à lavage à sec, l'eau des piscines et les eaux usées municipales et industrielles
-Dans la fabrication d'isolateurs de chaleur, de briques ignifuges et de matériaux d'emballage résistants aux incendies et aux acides
-Comme remplir la fabrication de papiers et de cartes, pour les rendre plus résistants
-Comme rempli de peintures pour améliorer son débit et sa couleur
-Dans les matériaux pour le polissage en métal et le bois, car ils leur donnent une abrasivité
-Dans les laboratoires d'analyse chimique en chromatographie et comme absorbant
-Comme antiaapelmazante des insecticides et des formules agrochimiques, pour aider à broyer la pesticide et comme porteuse du composé actif
-Comme support de catalyseur
-Comme remplissage pour renforcer le caoutchouc synthétique et les caoutchoucs
Peut vous servir: vagues longitudinales: caractéristiques, différences, exemples-En tant que porteuse de liquides dans les aliments pour animaux
-Dans les encres imprimées
-Comme dessiccant et adsorbant, sous forme de gel de silice
-Comme additif dans le ciment
-Comme sable d'animaux
-Dans les isolateurs de microélectronique
-Dans les commutateurs thermoptiques
 Gel de silice. Kenpei [cc by-sa 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons.
Gel de silice. Kenpei [cc by-sa 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons. Dans l'industrie alimentaire
Une silice amorphe est incorporée dans une variété de produits alimentaires comme ingrédient direct multifonctionnel dans divers types d'aliments. Vous ne devez pas dépasser 2% des aliments finis.
Par exemple, il sert d'antiaapelmazante (pour empêcher certains aliments de coller), comme stabilisateur dans la production de bière, comme antiprécipitateur, pour filtrer le vin, la bière et les jus de fruits ou les légumes.
 Équipe pour le filtrage de vin avec des diatomées (Sio2). Fabio Ingroso [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]. Source: Wikimedia Commons.
Équipe pour le filtrage de vin avec des diatomées (Sio2). Fabio Ingroso [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]. Source: Wikimedia Commons. Il agit comme un absorbant liquide dans certains aliments et la composante des microcapsules pour les huiles aromatisées.
De plus, le SIO2 Amorphes est appliqué par un processus spécial à la surface des plastiques d'articles pour emballer des aliments, agissant comme une barrière.
Dans l'industrie pharmaceutique
Il est ajouté en tant qu'agent antiaapelmazante, épaississant, gélifiant et comme excipient, c'est-à-dire comme assistant pour façonner plusieurs médicaments et vitamines.
Dans l'industrie des cosmétiques et les soins personnels
Il est utilisé dans une multitude de produits: dans les poudres faciales, les ombres à paupières, les yeux, les rouges à lèvres, les colorants, les abris de maquillage, les talcos, les poudres de pieds, les colorants et les Javels et le Javel.
Également dans les huiles et les sels de bain, les bains en mousse, les mains et la crème corporelle.
Également dans les crèmes d'hydratation nocturne, la luminosité et la peinture à l'ongle.
Dans les applications thérapeutiques
Le sio2 Il est présent dans le verre bioactif ou biovidrios dont la principale caractéristique est qu'ils peuvent réagir chimiquement avec l'environnement biologique qui les entoure, formant un lien fort et durable avec le tissu vivant.
Ce type de matériau sert à faire des substituts osseux tels que ceux du visage, comme "échafaudage" dans lequel les cellules osseuses se développent. Ils ont démontré une bonne biocompatibilité avec les os et les tissus mous.
Ces biovidrios permettront de récupérer les os du visage aux personnes qui les ont perdu par accident ou par maladie.
Des risques
Des particules de silice très minces peuvent être suspendues dans l'air et former des poudres non explosives. Mais cette poussière peut irriter la peau et les yeux. Son inhalation provoque une irritation des voies respiratoires.
De plus, l'inhalation de la poussière de silice produit des dommages à long terme des poumons, appelés silicose.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Dioxyde de silicone. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Da silva, m.R. et al. (2017). Techniques d'extraction verte. Sorbnts à base de silice. Dans la compréhension de la chimie analytique. Récupéré de ScienceDirect.com.
- Ylänen, h. (éditeur). (2018). Lunettes bioactives: matériaux, propriétés et applications (deuxième édition). Elsevier. Récupéré des livres.Google.co.aller.
- Windholz, M. et al. (éditeurs) (1983) L'indice Merck. Une encyclopédie des produits chimiques, des drarugs et des biologiques. Dixième édition. Merck & Co., Inc.
- Mäkinen, J. Et suni, t. (2015). Wafers Soi à film épais. Dans Handbook of Silicon MEMS Materials and Technologies (deuxième édition). Récupéré de ScienceDirect.com.
- Sirleto, L. et al. (2010). Commutateurs thermo-optiques. Nanocristaux de silicium. Récupéré de ScienceDirect.com.
- « Structure du fluorure de calcium (CAF2), propriétés, utilisations
- 275 pyropos pour hommes romantiques et sexy »

