Lewis structure en quoi il s'agit, comment il est fait, exemples

- 5063
- 1215
- Jade Duval
La Structure de Lewis C'est tout ce représentation de liaisons covalentes dans une molécule ou un ion. Dans ce document, ces liaisons et électrons sont représentés avec de longs points ou scripts, bien que la plupart du temps, les points correspondent aux électrons non partagés et aux scripts aux liaisons covalentes.
Mais qu'est-ce qu'un lien covalent? C'est le partage de quelques électrons (ou points) entre deux atomes du tableau périodique. Avec ces diagrammes, vous pouvez esquisser de nombreux squelettes pour un certain composé. Lequel d'entre eux est le bon dépendra des charges formelles et de la nature chimique des mêmes atomes.
 Composé 2-bromopropain. Par Ben Million [Domaine public], de Wikimedia Commons.
Composé 2-bromopropain. Par Ben Million [Domaine public], de Wikimedia Commons. Dans l'image supérieure, il y a un exemple de ce qu'est une structure Lewis. Dans ce cas, le composé représenté est le 2-bromopropano. Les points noirs correspondant aux électrons peuvent être vus, à la fois ceux qui participent aux liens et à ceux qui ne sont pas partagés (le seul couple juste au-dessus du BR).
Si les points de points ":" étaient remplacés par un long script "-", alors le squelette de carbone du 2 bromopropano serait représenté comme: C-C-C-C. Pourquoi au lieu du "cadre moléculaire" dessiné, pourrait-il être c-h-h-c? La réponse réside dans les caractéristiques électroniques de chaque atome.
Ainsi, parce que l'hydrogène n'a qu'un seul électron et une seule orbitale disponible à remplir, seulement une liaison covalente. Par conséquent, vous ne pouvez jamais former deux liaisons (et non confondu avec des ponts d'hydrogène). D'un autre côté, la configuration électronique de l'atome de carbone permet (et exige) la formation de quatre liaisons covalentes.
Pour cette raison, les structures de Lewis où C et H doivent être cohérentes et respecter ce qui est régi par leurs configurations électroniques. De cette façon, si le carbone a plus de quatre liais.
C'est ici que certaines des principales raisons ou dos de ces structures apparaissent, introduits par Gilbert Newton Lewis dans leur recherche de représentations moléculaires fidèles aux données expérimentales: la structure moléculaire et les charges formelles.
Tous les composés existants peuvent être représentés par Lewis Structures, donnant une première approche à la façon dont la molécule ou les ions pourrait être.
[TOC]
Quelle est la structure de Lewis?
Il s'agit d'une structure représentative des électrons de Valencia et des liaisons covalentes dans une molécule ou un ion qui sert à avoir une idée de sa structure moléculaire.
Cependant, cette structure ne prédit pas certains détails importants tels que la géométrie moléculaire par rapport à un atome et son environnement (s'il est carré, plat, bipiramidal, etc.).
Il ne dit pas non plus ce qu'est l'hybridation chimique de ses atomes, mais où les doubles ou les liaisons triples sont placées et s'il y a une résonance dans la structure.
Avec ces informations, vous pouvez discuter de la réactivité d'un composé, de sa stabilité, de la façon et du mécanisme que la molécule suivra lors de la réaction.
Pour cette raison.
Comment ça se fait?
Pour dessiner ou esquisser une structure, une formule ou un diagramme de Lewis, la formule chimique du composé est essentielle. Sans ça, tu ne peux même pas savoir quels sont les atomes qui se rédigent. Une fois avec lui, le tableau périodique est utilisé pour localiser quels groupes appartiennent.
Peut vous servir: Viscosité: exemples, causes, unités, typesPar exemple, si vous avez un composé C14SOIT2N3 Ensuite, nous devions rechercher les groupes où le carbone, l'oxygène et l'azote. Cela fait, quel que soit le composé, le nombre d'électrons de valence reste le même, si tôt ou tard ils mémorisent.
Ainsi, le carbone appartient au groupe TVA, à l'oxygène au groupe via et à l'azote à l'AV. Le nombre de groupes est égal à la quantité d'électrons (points) de Valence. Tous ont en commun la tendance à terminer l'octet de la couche Valencia.
Quelle est la règle des octets?
Cela dit qu'il y a une tendance des atomes pour compléter son niveau d'énergie avec huit électrons pour atteindre la stabilité. Cela s'applique à tous les éléments non métalliques ou ceux trouvés dans les blocs S ou P du tableau périodique.
Cependant, tous les éléments n'obéissent pas à la règle des octets. Les cas particuliers sont des métaux de transition, dont les structures sont plus basées sur les charges formelles et leur numéro de groupe.
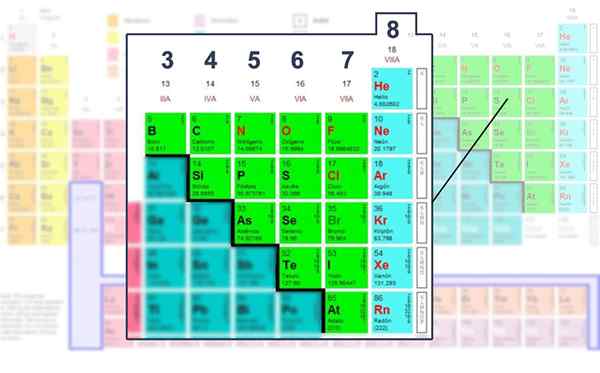 Nombre d'électrons de la couche Valencia des éléments non métalliques, ceux dans lesquels il peut être exploité avec la structure Lewis.
Nombre d'électrons de la couche Valencia des éléments non métalliques, ceux dans lesquels il peut être exploité avec la structure Lewis. Appliquer la formule mathématique
Sachant quel groupe appartient les éléments, et donc le nombre d'électrons de valence disponibles pour former des liens, la formule suivante est fabriquée, ce qui est utile pour dessiner les structures de Lewis:
C = n - D
Où c signifie électrons partagés, c'est-à-dire ceux qui participent aux obligations covalentes. Comme chaque lien est composé de deux électrons, alors C / 2 est égal au nombre de liens (ou scripts) qui doivent être dessinés.
N sont les électrons nécessaires, Ceux qui doivent avoir l'atome dans sa couche de Valencia pour être isoléctronique du noble gaz qui suit dans la même période. Pour tous les éléments autres que H (car il nécessite que deux électrons se comparent à lui), ils ont besoin de huit électrons.
D sont les électrons disponibles, qui sont déterminés par le groupe ou le nombre d'électrons de Valence. Ainsi, comme le CL appartient au groupe VIIA, il doit être entouré de sept noirs ou électrons, et gardez à l'esprit qu'un couple est nécessaire pour former un lien.
Ayant les atomes, leurs points et le nombre de liens C / 2, une structure Lewis peut alors être improvisée. Mais en plus, il est nécessaire d'avoir une notion d'autres "règles".
Où placer les atomes moins électronégatifs
Les atomes moins électronégatifs dans la grande majorité des structures occupent les centres. Pour cette raison, si vous avez un composé avec des atomes de P, O et F, le P doit donc être au centre de la structure hypothétique.
Il est également important de souligner que les hydrogènes sont généralement liés à des atomes très électronégatifs. Si vous avez dans un composé Zn, H et O, le H ira à côté du O et non avec le Zn (Zn-O-H et pas de H-Zn-O). Il y a des exceptions à cette règle, mais se produit généralement avec des atomes non métalliques.
Symétrie et charges formelles
La nature a une préférence élevée pour provoquer des structures moléculaires aussi symétriques que possible. Cela aide à éviter d'élever des structures désordonnées, avec les atomes organisés de telle manière qu'ils n'obéissent à aucun modèle apparent.
Il peut vous servir: Théories de la basse acide: Arrhenius, Bronsted-Lowry, LewisPar exemple, pour le composé C2POUR3, Là où A est un atome fictif, la structure la plus probable serait a-C-A-C-A. Notez la symétrie de leurs côtés, les deux reflets de l'autre.
Les charges formelles jouent également un rôle important lors du dessin des structures de Lewis, en particulier pour les ions. Ainsi, des liens peuvent être ajoutés ou supprimés afin que la charge formelle d'un atome correspond à la charge totale affichée. Ce critère est très utile pour les composés de métaux de transition.
Limitations dans la règle des octets
 Représentation du trifluoride en aluminium, un composé qui est instable. Les deux éléments sont composés de six électrons, ce qui génère trois liaisons covalentes, alors qu'elles devraient avoir huit pour atteindre la stabilité. Source: Gabriel Bolívar
Représentation du trifluoride en aluminium, un composé qui est instable. Les deux éléments sont composés de six électrons, ce qui génère trois liaisons covalentes, alors qu'elles devraient avoir huit pour atteindre la stabilité. Source: Gabriel Bolívar Toutes les règles ne sont pas respectées, ce qui ne signifie pas nécessairement que la structure est incorrecte. Des exemples typiques de cela sont observés dans de nombreux composés où des éléments du groupe IIIA (B, AL, GA, IN, TL) sont impliqués. Ici, est spécifiquement considéré comme un trifluoruro en aluminium (Alf3).
Puis appliquant la formule décrite ci-dessus, vous avez:
D = 1 × 3 (un atome d'aluminium) + 7 × 3 (trois atomes de fluor) = 24 électrons
Ici, les 3 et 7 sont les groupes respectifs ou le nombre d'électrons de valence disponibles pour l'aluminium et le fluorure. Ensuite, compte tenu des électrons nécessaires n:
N = 8 × 1 (un atome d'aluminium) + 8 × 3 (trois atomes de fluor) = 32 électrons
Et donc les électrons partagés sont:
C = n - D
C = 32 - 24 = 8 électrons
C / 2 = 4 liens
Étant donné que l'aluminium est l'atome le moins électronégatif, il doit être placé au centre et que le fluor ne forme qu'un lien. Compte tenu de cela, vous avez la structure Lewis del Alf3 (image supérieure). Les électrons partagés sont mis en évidence avec des points verts pour les distinguer des.
Bien que les calculs prévoient qu'il existe 4 liens qui doivent être formés, l'aluminium manque d'électrons suffisants et il n'y a pas non plus de quatrième atome de fluor. En conséquence, l'aluminium ne respecte pas la règle des octets et ce fait ne se reflète pas dans les calculs.
Exemples de structures Lewis
Iode
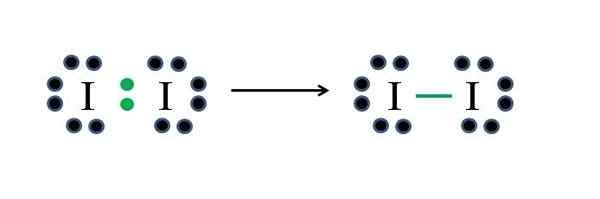 Iodo non-métals a sept électrons chacun, donc en partageant l'un de ces électrons chacun, ils génèrent une liaison covalente qui leur donne la stabilité. Source: Gabriel Bolívar
Iodo non-métals a sept électrons chacun, donc en partageant l'un de ces électrons chacun, ils génèrent une liaison covalente qui leur donne la stabilité. Source: Gabriel Bolívar L'iode est un halogène et appartient donc au groupe VIIA. Il a ensuite sept électrons de Valencia, et cette molécule diatomique simple peut être représentée en improvisant ou en appliquant la formule:
D = 2 × 7 (deux atomes d'iode) = 14 électrons
N = 2 × 8 = 16 électrons
C = 16 - 14 = 2 électrons
C / 2 = 1 lien
Comme 14 électrons 2 participent à la liaison covalente (points verts et script), 12 restent non partagés; Et parce qu'ils sont deux atomes d'iode, 6 doivent être distribués pour l'un d'eux (leurs électrons de valence). Dans cette molécule, seule cette structure est possible, dont la géométrie est linéaire.
Ammoniac
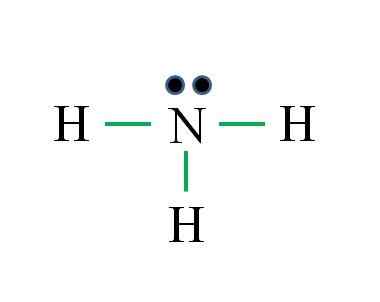 L'azote a 5 électrons, tandis que l'hydrogène seulement 1. Suffisant pour atteindre la stabilité lorsque trois liaisons covalentes sont établies, composées d'un électron de N et d'une autre source de H: Gabriel Bolívar
L'azote a 5 électrons, tandis que l'hydrogène seulement 1. Suffisant pour atteindre la stabilité lorsque trois liaisons covalentes sont établies, composées d'un électron de N et d'une autre source de H: Gabriel Bolívar Quelle est la structure de Lewis pour la molécule d'ammoniac? Comme l'azote provient du groupe VA, il a cinq électrons de Valence, puis:
Il peut vous servir: Thermomètre de laboratoire: caractéristiques, à quoi sert-il, utilisation, exemplesD = 1 × 5 (un atome d'azote) + 1 × 3 (trois atomes d'hydrogène) = 8 électrons
N = 8 × 1 + 2 × 3 = 14 électrons
C = 14 - 8 = 6 électrons
C / 2 = 3 liens
Cette fois, la formule a raison avec le nombre de liens (trois liens verts). Depuis les 8 électrons disponibles 6 participent aux liaisons, il y a un couple non partagé qui est situé au-dessus de l'atome d'azote.
Cette structure dit tout ce qui devrait être connu de la base de l'ammoniac. En appliquant les connaissances de TEV et TRPEV, il s'ensuit que la géométrie est tétraédrique déformée par le couple d'azote libre et que l'hybridation de ceci est donc SP3.
C2H6SOIT
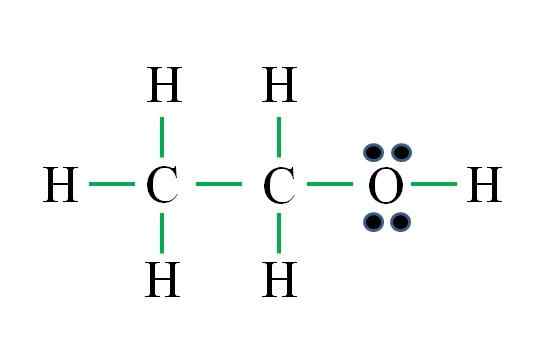 Source: Gabriel Bolívar
Source: Gabriel Bolívar La formule correspond à un composé organique. Avant d'appliquer la formule, il faut se rappeler que les hydrogènes forment une seule liaison, l'oxygène deux, le carbone quatre et que la structure doit être aussi symétrique que possible. Procéder comme les exemples précédents sont:
D = 6 × 1 (six atomes d'hydrogène) + 6 × 1 (un atome d'oxygène) + 4 × 2 (deux atomes de carbone) = 20 électrons
N = 6 × 2 (six atomes d'hydrogène) + 8 × 1 (un atome d'oxygène) + 8 × 2 (deux atomes de carbone) = 36 électrons
C = 36 - 20 = 16 électrons
C / 2 = 8 liens
Le nombre de scripts verts correspond aux 8 liaisons calculées. La structure Lewis proposée est celle de l'éthanol ch3Ch2Oh. Cependant, il aurait également été correct de proposer la structure de l'éther diméthylique3Och3, qui est encore plus symétrique.
Lequel des deux est "plus" correct? Les deux le sont également, car les structures sont apparues comme des isomères structurels de la même formule moléculaire C2H6SOIT.
Ion permanganate
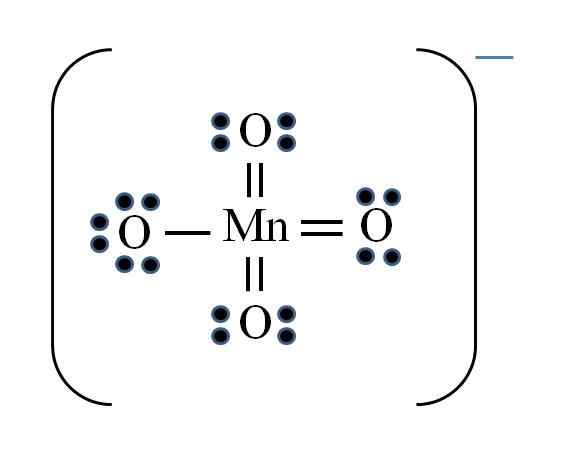 Source: Gabriel Bolívar
Source: Gabriel Bolívar La situation est compliquée lorsque vous voulez faire des structures Lewis pour les composés de métal de transition. Le manganèse appartient au groupe VIIB, également, l'électron de la charge négative doit être ajouté parmi les électrons disponibles. Appliquer la formule dont vous disposez:
D = 7 × 1 (un atome de manganèse) + 6 × 4 (quatre atomes d'oxygène) + 1 électron par charge = 32 électrons
N = 8 × 1 + 8 × 4 = 40 électrons
C = 40 - 32 = 8 électrons partagés
C / 2 = 4 liens
Cependant, les métaux de transition peuvent avoir plus de huit électrons à Valence. Aussi, pour l'ion MNO4- Présente la charge négative, il est nécessaire de réduire les charges formelles d'atomes d'oxygène. Comme? Via les doubles liens.
Si tous les liens du MNO4- Ils étaient simples, les charges formelles de l'oxygène seraient égales à -1. Puisqu'il y en a quatre, la charge résultante serait de -4 pour l'anion, ce qui n'est évidemment pas vrai. Lorsque les doubles liaisons sont formées, il est garanti qu'un seul oxygène a une charge formelle négative, reflétée dans l'ion.
Dans l'ion permanganate, on peut voir qu'il y a une résonance. Cela implique que la seule liaison MN-O simple est démocalisée entre les quatre atomes d'O.
Ion dicromato
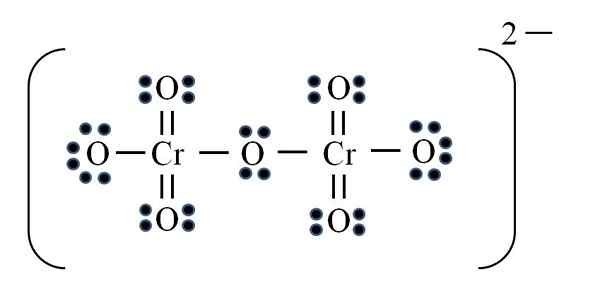 Source: Gabriel Bolívar
Source: Gabriel Bolívar Enfin, un cas similaire se produit avec l'ion dicromato (Cr2SOIT7). Le chrome appartient au groupe VIB, il dispose donc de six électrons de Valence. Appliquer à nouveau la formule:
D = 6 × 2 (deux atomes de chromé) + 6 × 7 (sept atomes d'oxygène) + 2 électrons par la charge divalent = 56 électrons
N = 8 × 2 + 8 × 7 = 72 électrons
C = 72 - 56 = 16 électrons partagés
C / 2 = 8 liens
Mais il n'y a pas de 8 liens, mais 12. Pour les mêmes raisons trouvées, dans l'ion permanganate, deux oxygène doivent être laissés avec des charges formelles négatives qui ajoutent égales à -2, la charge de l'ion dicromato.
Ainsi, comme de nombreux doubles liens sont ajoutés si nécessaire. De cette façon, vous atteignez la structure Lewis de l'image pour le CR2SOIT72-.
Les références
- Whitten, Davis, Peck & Stanley. Chimie. (8e Ed.). Cengage Learning, p 251.
- Structures de Lewis. Pris de: Chemed.Chem.Purger.Édu
- Steven A. Hardinger, Département de chimie et de biochimie, UCLA. (2017). Structure de Lewis. Tiré de: Chem.Ucla.Édu
- Wayne Breslyn. (2012). Dessin les structures de Lewis. Tiré de: terpconnect.Umd.Édu
- Webmaster. (2012). Structures Lewis ("Dot électronique"). Département de chimie, Université du Maine, Orono. Tiré de: chimie.Umeche.Maine.Édu
- Lancaster, Sean. (25 avril 2017). Comment déterminer le nombre de points sur une structure de points Lewis d'un élément. Science. Récupéré de: science.com
- « Caractéristiques et exemples d'administration privée
- Théories d'apprentissage Caractéristiques et auteurs principales »

