Électrophorèse de fondation, technique, à quoi sert-il, exemples

- 4702
- 1107
- Paul Dumas
La Électrophorèse C'est une technique utilisée pour séparer les molécules dans un champ électrique. Il doit faire, en particulier, avec la migration de particules chargée sous l'influence d'un courant électrique appliqué entre deux pôles, un positif et un autre négatif.
L'électrophorèse est actuellement l'une des procédures les plus routinières qui se déroulent lors du développement d'une expérience, en particulier dans les domaines liés à la chimie analytique, à la biochimie et aux sciences biologiques et médicales en général.
 Seau d'électrophorèse. Source: Melodygar / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)
Seau d'électrophorèse. Source: Melodygar / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0) Il est utilisé pour séparer les protéines, les peptides, l'ADN, l'ARN et d'autres en fonction de leur charge, de leur taille, de leur densité et de leur pureté.
Les différentes maisons commerciales ont conçu des formats différents, avec des applications différentes et des bénéfices appropriés à des fins spécifiques, cependant, toutes les procédures nécessitent les mêmes éléments de base:
- Une source d'énergie pour générer une charge électrique
- Un moyen de soutien à la séparation
- Une solution tampon (amortir) Pour garder le pH constant
[TOC]
Base
L'électrophorèse n'est rien de plus que la migration (séparation) des particules ou des molécules chargées (naturellement ou artificiellement) dans un milieu ou un support sous l'influence d'un champ électrique.
La technique est basée sur l'une des principales équations physiques de l'électromagnétisme, selon laquelle la force est égale à la charge électrique multipliée par le champ électrique appliqué à ce point (F (force) = q (charge électrique) x E (champ électrique ).
Selon cette équation, deux particules avec la même masse, mais d'une charge différente, se déplaceront à des taux différents dans le même champ électrique. De plus, la vitesse de mouvement de ces particules dépendra de la relation entre leur charge et leur masse.
Les scientifiques ont profité de ces propriétés et de ces relations de fret / masse pour séparer les composants des biomolécules dans leurs plus petites parties, ainsi que pour séparer différentes molécules dans un mélange, entre autres applications.
Il est important de se rappeler que les molécules biologiques telles que les acides aminés, les peptides, les protéines, certains glucides, les nucléotides et les acides nucléiques ont tous quelque chose que nous appelons des "groupes ionisables", afin qu'ils puissent exister comme des espèces positives ou chargées négativement dans certaines conditions de pH.
Technique
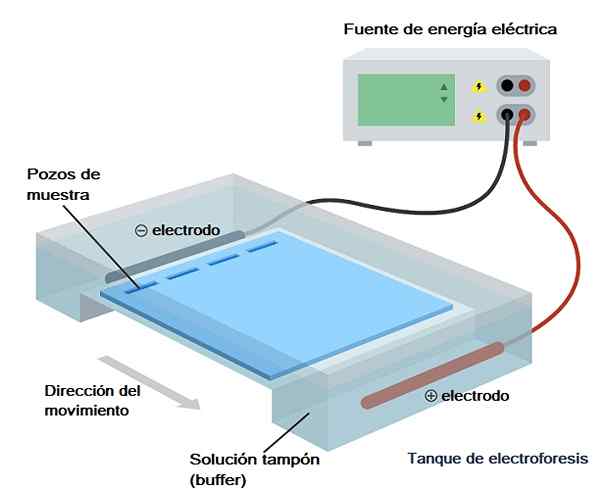
Bien qu'il existe différents types d'électrophorèse, l'électrophorèse sur gel est la plus utilisée dans l'analyse biochimique, la biologie moléculaire et la biotechnologie, ce sera donc ce dont nous parlerons brièvement en termes techniques.
Comme son nom l'indique, l'électrophorèse sur gel implique l'utilisation d'un milieu de support solide à forme solide, soit pour l'analyse / séparation des mélanges de protéines ou d'acides nucléiques (ADN et / ou ARN) sous l'influence d'un champ électrique.
Le système ou l'appareil utilisé pour effectuer un «run» électrophorétique peut être horizontal (généralement utilisé pour les acides nucléiques) ou vertical (généralement utilisé pour les protéines).
- Exemple de la technique de l'électrophorèse d'acide nucléique
Les acides nucléiques sont généralement séparés à l'aide de gels d'agarose (Galactose Polysaccharide) qui est préparé avec une solution tampon adéquate (Tris / acétate / EDTA ou Tris / Borato / EDTA) et dont la concentration déterminera la "résolution" des fragments de différentes tailles.
Peut vous servir: la chaîne alimentaire de la Terre: liens et exempleLa préparation des échantillons
La première étape avant d'effectuer une course électrophorétique dans un gel d'agarose est d'obtenir l'échantillon. Cela dépendra de l'extrémité expérimentale et les échantillons peuvent être le produit d'une digestion enzymatique, d'une réaction en chaîne par polymérase (PCR), une purification des acides nucléiques, etc.
 Mélange de l'échantillon avec le buff de charge.Org / licences / par / 4.0) via Wikimedia Commons)
Mélange de l'échantillon avec le buff de charge.Org / licences / par / 4.0) via Wikimedia Commons) Après avoir obtenu, ceci est mélangé avec une solution colorée (solution de charge) qui permet le dépôt rapide de l'échantillon dans un puits, car il a du glycérol et un colorant qui permet la course visuellement.
Préparation du gel
Cette étape consiste à mélanger la quantité nécessaire du substrat gélifiant (l'agarose) avec la solution tampon, en la faisant fondre en utilisant la chaleur et en la solidifiant sur un support qui fonctionne comme "moisissure".
Pendant la gélification, certains "peignes" sont introduits dans le gel positionné dans le "moule" pour délimiter les "puits" où les échantillons seront introduits avant la course.
Une fois que le gel s'est refroidi et solidifié, les "peignes" sont supprimés et il est introduit dans un conteneur appelé "godet", plein de solution de tampon de course (Tris / acétate / EDTA ou Tris / Borato / Borato / Edta).
Ce seau est, à son tour, inclus dans ce qu'on appelle la «chambre électrophorétique», qui n'est rien de plus que le conteneur à travers lequel le champ électrique est passé et qui a un espace où le gel est introduit et deux sections dont ils sont remplis solution de tampon (amortir courir).
Cette caméra a deux électrodes, une positive et une négative, parmi laquelle le mouvement ionique est produit après l'application d'un champ électrique (il est connecté à une source d'alimentation).
Chargement des échantillons
Une fois que les échantillons se sont mélangés à la solution de charge respective, celles-ci sont introduites dans les "puits" précédemment fabriqués dans le gel.
Étant donné que les acides nucléiques ont une charge nette négative, ils migrent du pôle négatif vers le positif, donc cela doit être pris en compte lorsque la caméra est connectée à la source d'alimentation, en s'assurant que le poteau négatif correspond au site le plus à côté de l'endroit où les échantillons ont été chargés.
Le temps de Corrida est établi dans une stricte dépendance à l'égard du chercheur en charge de l'expérience. La tension est généralement calculée dans un rapport de 5 volts par centimètre dans le gel qui sépare les deux électrodes.
Afficher
Lorsque le gel fonctionne (lorsque les échantillons ont parcouru le gel d'un bout à l'autre), il est submergé dans une solution de bromure éthique (ETBR), un colorant qui est entrecoupé entre les bases azotées et la "marque", ainsi Ils peuvent être visualisés dans un transimenant en utilisant une lumière ultraviolette.
Qu'est-ce que l'électrophorèse pour?
L'électrophorèse a historiquement été utilisée à des fins multiples. Aujourd'hui, cependant, son utilité dépend en grande partie de la «question» que le chercheur est posé par rapport à un phénomène ou à un système particulier, ainsi que le type d'électrophorèse qu'il souhaite utiliser.
Peut vous servir: topoisomérase: quelles sont les caractéristiques, les fonctions, les typesNous pouvons cependant enrôler certaines des principales fonctions de cette technique, en commençant par les plus "rares" et se terminant par les plus populaires et principalement exploités dans le monde des sciences biologiques. L'électrophorèse est utile:
- Pour l'analyse quantitative des mélanges complexes de macromolécules et pour le calcul du "zêta" potentiel (propriété colloïdale d'une particule dans un milieu liquide sous l'influence d'un champ électrique statique).
- Pour l'analyse du sérum sanguin à des fins de diagnostic.
- Pour la séparation des glucoprotéines, des lipoprotéines et de l'hémoglobine sanguine.
- Pour l'analyse alimentaire, les produits pharmaceutiques et les polluants environnementaux.
Électrophorèse dans les gels d'agarose
- Pour la séparation des fragments d'ADN après la digestion avec des enzymes de restriction.
- Pour la séparation des molécules d'acide nucléique avant le transfert vers les membranes pour les analyses ultérieures.
- Pour l'analyse des produits de PCR (réaction en chaîne par polymérase) vérifiant s'il s'est produit ou non.
- Pour l'estimation de la taille des molécules dans un mélange d'ADN ou d'ARN.
- Pour l'estimation de la quantité et / ou de la qualité des acides nucléiques purifiés.
Électrophorèse dans les gels de polyacrylamide dans des conditions dénaturés ou indigènes
- Pour déterminer la taille d'une protéine.
- Pour identifier les protéines.
- Pour déterminer la pureté d'un échantillon après plusieurs étapes de purification.
- Pour identifier la présence de liens de disulfure intramoléculaires.
- Pour déterminer l'interaction entre les protéines.
- Pour déterminer le point isoélectrique d'une protéine.
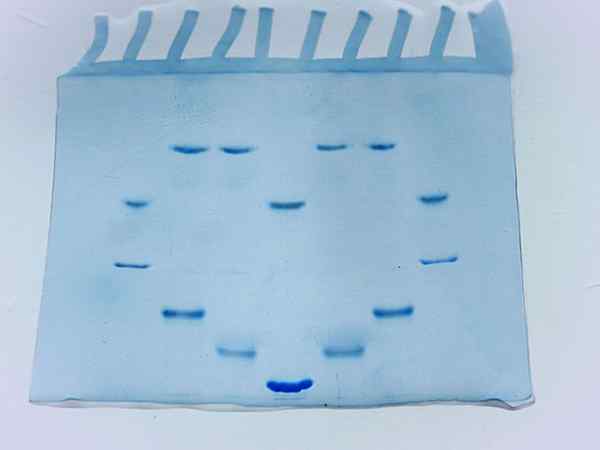 Photographie d'un gel d'acrylamide après la course de plusieurs échantillons de protéines (source: Larionova.Marina / CC By-Sa (https: // CreativeCommons.Org / licences / by-sa / 4.0) via Wikimedia Commons)
Photographie d'un gel d'acrylamide après la course de plusieurs échantillons de protéines (source: Larionova.Marina / CC By-Sa (https: // CreativeCommons.Org / licences / by-sa / 4.0) via Wikimedia Commons) Facteurs qui affectent l'électrophorèse
La migration d'une particule dans un champ électrique dépend de divers facteurs, parmi lesquels sont:
- Votre charge électrique
- Sa taille moléculaire
- Son hydrophobicité et sa forme
- L'ampleur du champ électrique appliqué
- La température du système et la force ionique de la solution tampon utilisée
- La nature de l'environnement où il est situé
Par rapport à l'échantillon
Parmi les paramètres liés aux particules (échantillon) qui sont soumises à un champ électrique, les principaux facteurs qui affectent ce processus ont à voir avec leur charge, leur taille et leur forme.
Plus la charge nette d'une particule est grande, plus son taux de migration est grand et cette ampleur dépendra du pH. Cependant, la relation avec la taille est inversement proportionnelle, ce qui signifie que plus la molécule «grande» est «grande», plus.
Il peut vous servir: lia gél (iron lysine): qu'est-ce que la fondation, la préparation, les utilisationsPar rapport au champ électrique
Jusqu'à présent, nous avons parlé de l'importance du champ électrique pour réaliser le mouvement d'une particule par électrophorèse, mais nous n'avons pas défini ce que c'est: la force électrique par unité de charge ou, en termes plus simples, une région d'espace où il y a une force électrique.
Les paramètres concernant le champ électrique qui peuvent affecter la migration sont la tension, le courant et la résistance.
La tension affecte le «temps de vol» des molécules qui sont séparées après avoir appliqué le champ électrique. Plus il est élevé, plus ces mouvements.
Le courant (électrons continus et uniformes qui sont «poussés» par la source de tension) est effectué entre les électrophorétiques des électrodes du système grâce aux ions présents dans la solution tampon. Est directement lié à la tension.
Par rapport à la solution tampon
La composition, la force ionique et le pH de la solution de tampon sont les principaux paramètres qui affectent une "course" électrophorétique, car elles influencent directement certaines des propriétés des échantillons, en particulier la charge électrique.
Parce que? La solution tampon stabilise le pH du milieu de support où se produit l'électrophorèse. Sa composition peut affecter le déplacement des particules migrées et la concentration ionique également, car elle est directement liée au courant.
Par rapport au support
Les différents types et formats d'électrophorèse présentent également différents milieux sur lesquels la migration se produit et où il peut être «enregistré» par la suite ».
Le taux de migration des molécules soumis à une électrophorèse dépend du type de milieu de support, qui devrait généralement être inerte.
Ses caractéristiques d'absorption, l'électroendo-osmose sont importantes (capacité de mouvement d'un liquide à travers une membrane sous l'influence d'un champ électrique) et sa capacité de tamis moléculaire.
Exemples d'utilisation de l'électrophorèse
Les exemples classiques de techniques électrophorétiques utilisées en biologie et biotechnologie comprennent:
- Électrophorèse en gels d'agarose (anglais Gel d'électrophorèse)
- Électrophorèse dans les gels d'acrylamide dans des conditions dénaturalisantes (SDS-PAGE, Anglais Électrophorèse du gel de polyacrylamide de dodécyl sulfat de sodium)
- Électrophorèse dans les gels d'acrylamide dans des conditions indigènes (BN-PAGE, anglais Électrophorèse de gel de polyacrylamide natif bleu)
- Électrophorèse en deux dimensions (2d-pages, de l'anglais Électrophorèse sur gel de polyacrylamide bidimensionnel)
- Électrophorèse capillaire (de l'anglais Capillaire électrophorèse)
- Isolectroenfoque (anglais Isolant)
- Électrophorèse sur le terrain pulsé (anglais Électrophorèse sur le terrain pulsé)
Les références
- Beck, Kevin. (2020, 25 mai). Les types d'électrophorèse. Science.com. Récupéré de la science.com
- Essais, Royaume-Uni. (Novembre 2018). Types et applications d'électrophorèse. Récupéré de UKESSAYS.com
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Parmar, P. (Août 2018). Électrophorèse: signification, définition et classification (avec diagramme). Technologie bio. Récupéré de la biotechnologie.com
- Perrett, D. (2010). 200 ans d'électrophorèse. Chromatog. Aujourd'hui, 4-7.
- Righetti, P. g. (2005). Électrophorèse: la marche des sous, la marche des dix sous. Journal of Chromatography A, 1079 (1-2), 24-40.
- Rilbe, H. (Année mille neuf cents quatre-vingts-quinze). Som reminisciones de l'histoire de l'électrophorèse. Électrophorèse, 16 (1), 1354-1359.
- Vesterberg, ou. (1993). Une courte histoire de méthodes électrophorétiques. Électrophorèse, 14 (1), 1243-1249.
- Vinayagam, m. (Pas de date). Facteurs affectant l'électrophorèse. Académie.Édu. Récupéré du monde universitaire.Édu
- « Explication de l'équilibre chimique, facteurs, types, exemples
- Origine de la culture toltec, emplacement, caractéristiques, organisation »

