Explication de l'équilibre chimique, facteurs, types, exemples

- 4192
- 317
- Noa Da silva
Il équilibre chimique C'est un état qui atteint les réactions chimiques réversibles dans lesquelles aucune variation de concentrations, ou réactifs, ni des produits impliqués ne sont produits. Il est caractérisé par le fait d'être dynamique et non statique; c'est-à-dire que les molécules ou les atomes continuent de réagir, mais en maintenant les mêmes concentrations pendant le temps.
Un équilibre similaire est également présenté dans les changements de phase, bien qu'il n'y ait pas de rupture de lien. Par exemple, un liquide peut être en équilibre avec ses vapeurs, ainsi qu'un solide. De même, un solide établit un équilibre avec les eaux qui l'entourent lorsqu'il a précipité ou cristallisé.
 Dans l'industrie chimique, la connaissance de l'équilibre chimique est essentielle pour obtenir une synthèse avec de meilleurs rendements. Source: pxhere.
Dans l'industrie chimique, la connaissance de l'équilibre chimique est essentielle pour obtenir une synthèse avec de meilleurs rendements. Source: pxhere. Une fois l'équilibre chimique établi, il n'est pas possible d'obtenir plus de changements ou de réponses à moins qu'il soit interrompu ou affecté par des actions externes. Il s'agit donc, dans la synthèse d'un produit, plusieurs paramètres tels que la pression, le volume ou la température sont modifiés, de sorte que la quantité maximale de produit est générée en équilibre.
Sinon, en équilibre, les quantités de produits ne seront pas satisfaisantes; c'est-à-dire qu'il y aura de mauvaises performances de réaction. C'est pourquoi l'équilibre chimique est vital pour l'industrie chimique, et en général pour toute synthèse quelle que soit son échelle.
Dans l'équilibre chimique, il peut y avoir plus de produits, ou plus de réactifs. Tout dépend de l'endroit où l'équilibre est déplacé. Compte tenu de plusieurs facteurs, vous pouvez déplacer un équilibre vers l'une des deux directions de la double flèche dans la réaction réversible.
[TOC]
Explication de l'équilibre chimique
Avant équilibre
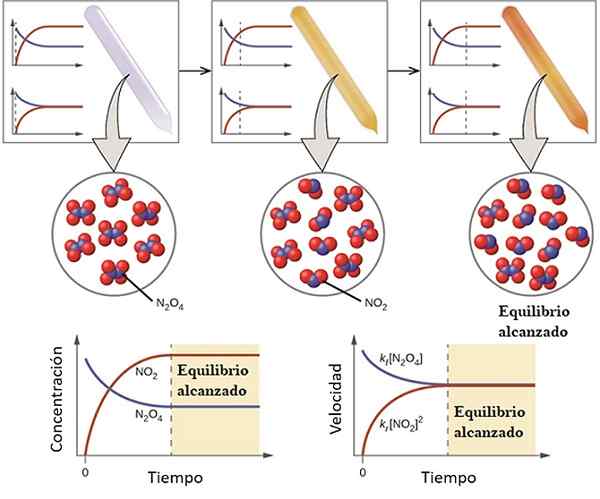 Exemple de la façon dont une réaction aborde son équilibre. Source: OpenStax / CC par (https: // CreativeCommons.Org / licences / par / 4.0)
Exemple de la façon dont une réaction aborde son équilibre. Source: OpenStax / CC par (https: // CreativeCommons.Org / licences / par / 4.0) Pour comprendre ce qu'est l'équilibre chimique, considérez la réaction réversible suivante:
N2SOIT4(g) ⇌ Non2(g)
Le gaz n2SOIT4 Il est incolore, tandis que le gaz ne2 présente une coloration brune ou brune. Si une quantité spécifique de n est injectée dans un petit flacon ou un conteneur2SOIT4, Ce sera incolore jusqu'à ce que l'équilibre soit établi.
À gauche de l'image supérieure, on peut voir que presque toutes les molécules sont de n2SOIT4 et que la concentration de non2 C'est nul.
Affichez également deux graphiques qui représentent à quoi ressemble la tendance dans la balance, la ligne pointillée pointant la position au moment où seul le N est injecté2SOIT4. Un graphique correspond à la concentration vs. Temps (en aval) et l'autre correspond au graphique à la vitesse vs. Temps (basse à droite).
La concentration de n2SOIT4, [N2SOIT4] (Ligne bleue) diminuera progressivement, car une partie de celle-ci se dissociera pour produire des molécules de non2. Ainsi, étant la concentration de non2, [NON2] (ligne rouge) égale à zéro au début, augmentera bientôt à mesure que le n2SOIT4 Dissocier.
Cependant, c'est une réaction réversible: une partie des molécules sans2 Ils se joindront pour former n2SOIT4. Il y aura donc deux réactions, la directe et l'inverse, chacune avec ses propres vitesses.
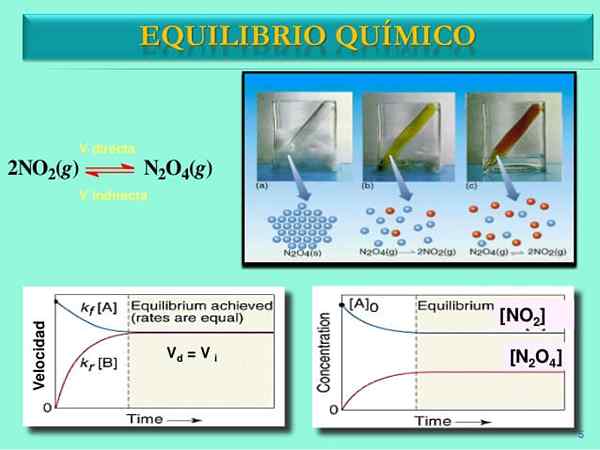 Source: SlideShare.filet
Source: SlideShare.filet Vitesses de réaction
Au début, la vitesse de consommation de n2SOIT4 est supérieur à la vitesse de consommation de non2. Évidemment, n'ayant que n2SOIT4, les quelques molécules formées de non2 Ils peuvent à peine se retrouver pour réagir. À ce stade, le flacon commencera à picoter l'orange, car il y a un mélange de n2SOIT4 et non2.
Petit à petit, car il y a plus de molécules de non2 Sur la route et que les n molécules2SOIT4 Ils se dissocient, les vitesses des deux réactions correspondront, même si les concentrations diffèrent les unes des autres. C'est-à-dire non2] a tendance à être supérieur à [n2SOIT4], c'est pourquoi la ligne rouge est au-dessus de la ligne bleuâtre.
Peut vous servir: propriétés physicochimiquesNotez que la vitesse devient DC / DT, c'est-à-dire le changement de concentration en ce qui concerne le temps. C'est pourquoi les deux C vs. t et V contre. T ne sont pas identiques.
En équilibre
Une fois la paire n2SOIT4-NON2 Réglez l'équilibre, les vitesses des deux réactions seront appariées et les expressions mathématiques suivantes seront obtenues:
Vdirect = k1[N2SOIT4]]
Vinverse = k-1[NON2]]2
Vdirect = Vinverse
k1[N2SOIT4] = k-1[NON2]]2
k1/ k-1 = [Non2]]2/ [N2SOIT4]]
Kégaliseur = [Non2]]2/ [N2SOIT4]]
À ce stade, la route sera encore plus teinte que brun, car l'équilibre est plus déplacé vers la formation de [non2]]. C'est-à-dire kégaliseur, La constante d'équilibre doit être supérieure à 1 en tenant compte de la relation plus élevée, [non2]]2/ [N2SOIT4]].
Dans les concentrations d'équilibre [n2SOIT4] et non2] Ils restent constants, les deux réactions se produisant à la même vitesse: une certaine quantité de n est simplement dissociée2SOIT4, La même quantité sera produite immédiatement en raison de la réaction d'un certain montant de non2.
Pour cette raison, il est dit que l'équilibre chimique est dynamique: les molécules n2SOIT4 et non2 Ils participent toujours à des réactions même lorsqu'il n'y a pas de changement dans leurs concentrations.
Et étant les vitesses de réaction égales pour les deux sens, la ligne rouge et bleuâtre dans les graphiques V contre. t jouer sur une ligne horizontale.
Constante d'équilibre
La constante d'équilibre pour la réaction précédente sera toujours la même, à une certaine température, quelle que soit la quantité de n2SOIT4 est injecté au début de la route. Ce sera ainsi même si un mélange de n est directement injecté2SOIT4 et non2, puis laissé au repos jusqu'à ce que l'équilibre atteigne.
Lorsque l'équilibre est atteint et que les concentrations sont mesurées [n2SOIT4] et non2], la relation [non2]]2/ [N2SOIT4] donnera la même chose à kégaliseur Pour cette réaction. Plus il est grand (keq >> 1), plus il y aura de produits en équilibre. Et le plus petit (Keq << 1), más reactivos habrá en el equilibrio.
Concentrations [n2SOIT4] et non2] Ils ne seront pas toujours. Par exemple, si de petits volumes sont injectés dans le flacon, ou si au contraire, ils sont injectés de torrents de ces gaz dans un réacteur, les quantités varieront considérablement. Cependant, kégaliseur Il restera le même tant que la température est la même dans les deux processus.
Kégaliseur Il est sensible aux changements de température: à une température plus élevée, une plus grande valeur sera. C'est-à-dire à une température plus élevée, en équilibre, il tendra à la formation de plus de produits. Il en est ainsi à moins que la réaction ne soit exothermique, comme cela sera expliqué dans la section suivante.
Facteurs qui affectent l'équilibre chimique
Les facteurs qui affectent l'équilibre chimique dans une réaction réversible sont: la concentration, la pression et la température.
- Concentration
Dans une réaction réversible, selon le principe de Le Chatlier, en augmentant la concentration d'un réactif, il y aura un déplacement de l'équilibre chimique à droite, afin d'augmenter la concentration des produits de réaction.
Au contraire, si un produit est ajouté à la réaction, l'équilibre chimique se déplacera vers la gauche, afin d'augmenter la concentration des réactifs. Si la réaction suivante est prise comme exemple:
C (s) + o2(g) ⇌ 2 Co (g)
En augmentant la concentration des réactifs (C et O2), L'équilibre se déplacera vers la droite, c'est-à-dire vers la formation du produit de monoxyde de carbone (CO) (CO). Mais une augmentation de la concentration de CA produira un déplacement de l'équilibre vers la gauche, pour augmenter la concentration de C et O2.
Il peut vous servir: groupe carbonyle: caractéristiques, propriétés, nomenclature, réactivité- Pression
Dans une réaction développée en phase gazeuse, une variation du volume ou de la pression exercée sur les gaz impliqués, produira une altération de l'équilibre, en fonction du nombre de moles des réactifs et des produits.
Si les composants d'une réaction (réactifs et produits) ont des différences dans le nombre de moles impliquées dans une réaction, par exemple, la dimérisation du dioxyde d'azote (non2):
2 Non2(g) ⇌2SOIT4(g)
Une augmentation de la pression exercée lors de la réaction en phase gazeuse, une conséquence d'une diminution ou non du volume de la réaction, entraînera un déplacement de l'équilibre chimique sur le côté qui a moins de moles de gaz. Dans cet exemple: produit n2SOIT4.
Au contraire, une diminution de la pression produira un déplacement de l'équilibre sur le côté de la réaction qui possède le plus grand nombre de moles de gaz. Dans l'exemple donné, il se déplacera vers les réactifs (non2), Afin de contrer la diminution de la pression.
Si dans une réaction en phase de soude, les moles des réactifs sont égales aux moles des produits, les changements de pression n'affecteront pas l'équilibre chimique.
- Température
Réaction endothermique
Dans une réaction endothermique, la chaleur peut être considérée comme un réactif, car son alimentation est nécessaire pour que la réaction se produise:
A + Q ⇌ B
Q = chaleur fournie
Par conséquent, dans une réaction endothermique lorsque la température augmente, l'équilibre se déplacera vers la droite. Pendant ce temps, lorsque la température diminue, l'équilibre se déplace vers la gauche.
La chaleur faisant partie des réactifs, pour le consommer pour se transformer en b.
Réaction exothermique
Dans une réaction exothermique, la chaleur est générée, ce qui est un produit de la réaction:
A ⇌ B + Q
Dans une réaction exothermique lorsque la température augmente, l'équilibre se déplacera vers la gauche (réactifs), car la production de chaleur augmente. En attendant, lorsque la température diminuera, l'équilibre se déplacera vers la droite (produits).
La chaleur faisant partie des produits, lorsque la température augmentera, il n'y aura pas besoin de contribuer plus de chaleur à l'environnement. Et par conséquent, l'équilibre cherchera à profiter de la chaleur supplémentaire pour produire plus de réactifs; Dans ce cas, plus de.
Types d'équilibre chimique
Selon l'état physique des composants de réaction, l'équilibre chimique peut être homogène ou hétérogène.
Équilibre homogène
Dans ce type d'équilibre, tous Les réactifs et les produits ont la même phase ou le même statut liquide. Par exemple:
N2(g) +3 h2(g) ⇌ 2 NH3(g)
Voici ainsi2, comme h2 Et le NH3 Ce sont des substances gazeuses.
Équilibre hétérogène
Existe quand pas tous Les réactifs et les produits ont la même phase ou la même condition physique. Par exemple:
2 Nahco3(s) ⇌ na2CO3(S) + CO2(g) + h2O (g)
Ici, nous avons le Nahco3 et na2CO3 comme des solides, et le CO2 et h2Ou comme des gaz ou des vapeurs.
Exemples d'équilibre chimique
Dissociation de l'acide acétique dans l'eau
Acide acétique, CHO3COOH, se dissocie dans l'eau établissant un équilibre:
Ch3COOH (AC) + H2Ou (l) ⇌ Cho3Roucouler-(AC) + H3SOIT+(AC)
Réaction dont la constante d'équilibre est appelée constante d'acidité.
Isomérisationsoitn du butane
Le gaz n-Le butano peut être isomérisé en fonction de la réaction réversible suivante pour produire l'isomère isomère:
Ch3Ch2Ch2Ch3(g) ⇌ Cho3Ch (ch3)2(g)
Formation d'oxyde nitrique dans l'atmosphère
Dans l'atmosphère, l'oxyde nitrique peut se former, bien que très à peine, à partir d'azote et d'oxygène d'air:
N2(g) + ou2(g) ⇌ 2NO (g)
Il peut vous servir: quel est le milieu de l'échec? (Exemples de calcul)Le Kégaliseur De cette réaction est de 2 · 10-31 à 25 ºC, donc une quantité méprisable de non sera formée.
RéactionsoitN de comproduction en argent avec AmonToiCA
Ions argentés, AG+, Ils peuvent être achevés avec l'ammoniac en fonction de la réaction réversible suivante:
Agir+(Soleil) + 2NH3(L) ⇌ [AG (NH3)2]]+(soleil)
Exercices résolus
Exercice 1
Quel type d'équilibre chimique correspond à la réaction suivante?
2NOCl (g) ⇌ 2NO (G) + Cl2(g)
Cette réaction correspond à un équilibre homogène, car toutes les substances impliquées, NOCL, NO et CL2, Ce sont des gaz.
Exercice 2
Pour la même réaction d'en haut, quel changement d'équilibre pourrait être attendu si la pression augmentait soudainement?
Comptons les moles des réactifs:
2NOCL
Nous avons 2 moles de NOCL. Maintenant, disons les taupes des produits:
2NO + CL2
Nous avons trois moles: deux de NO, et un de Cl2. Il y a plus de moles gazeuses sur le côté des produits. Par conséquent, une augmentation de la pression entraînera un set d'équilibre vers le côté gauche, vers la formation de NOCL. De cette façon, le système cherche à adoucir les effets de la pression favorisant la formation de NOCL et non de NO et CL2.
Exercice 3
Pour la même réaction d'en haut, supposons qu'un volume considérable de CL soit soudainement injecté2. Qu'est-ce qui arrivera à l'équilibre?
Lors de l'ajout de CL2 Pour le réacteur ou le récipient, sa concentration augmente à mesure que le produit de la réaction. Et par conséquent, l'équilibre reviendra vers la gauche, pour former plus de Nocl.
Exercice 4
Si la dissociation de NOCL à 227 ºC a une constante d'équilibre de 4 de 4.5 · 10-4, Dans quelle direction est l'équilibre déplacé?
Encore une fois, être kégaliseur Moins de 1 (4.5 · 10-4 < 1), en el equilibrio se espera que haya más NOCl que NO o Cl2, Puisqu'il est déplacé à gauche.
Exercice 5
Selon la réaction suivante en équilibre:
[CO (oh2)6]]2+(AC) + 4Cl-(Ac) + q ⇌ [cocl4]]2-(AC) + 6H2Ou (l)
Et sachant que le complexe [co (oh2)6]]2+ Il est rose, et que le complexe est [cocl4]]2- C'est bleuâtre, quels changements vous attendriez-vous à voir si vous chauffez un conteneur avec [CO (oh2)6]]2+? Que vous attendriez-vous à voir si après chauffer le récipient, je le placerais dans une salle de bain avec de la glace?
La réaction est endothermique, car elle absorbe la chaleur qui comme réactif. Par conséquent, lors du chauffage du récipient avec [CO (OH2)6]]2+, L'équilibre se déplacera vers la droite, vers la formation de [cocl4]]2-. Un changement de coloration rose bleuâtre sera.
Ensuite, si le récipient de coloration bleuâtre avec [cocl4]]2- Il est placé dans une salle de bain avec de la glace, la réaction va maintenant se déplacer vers la gauche, vers la formation de CO (OH2)6]]2+:
[Cocl4]]2-(AC) + 6H2Ou (l) ⇌ [co (oh2)6]]2+(AC) + 4Cl-(Ac) + q
En effet, la réaction inverse est exothermique, ayant la chaleur comme un produit. Par conséquent, lors du refroidissement du récipient avec [cocl4]]2- Bleu, le complexe [co (oh (oh2)6]]2+, Et la couleur rose réapparaîtra.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Préparation émédicale. (s.F.). Types d'équilibre. Récupéré de: emedicprep.com
- Lumen Chimie sans limites. (s.F.). Facteurs qui compensent l'équilibre chimique. Récupéré de: cours.Lumenarning.com
- Wikipédia. (2020). Équilibre chimique. Récupéré de: dans.Wikipédia.org
- CHIMISTER BOOLISTexts. (24 mai 2020). Calculs d'équiquime - Examplies sous-illustratives. Récupéré de: Chem.Bibliothèque.org
- Meyers Amy. (2020). Équilibre: chimique et dynamique. Étude. Récupéré de: étudier.com
- Helmestine, Anne Marie, Ph.D. (11 février 2020). Équilibre chimique dans les réactions chimiques. Récupéré de: Thoughtco.com
- « Cultures du Guatemala Caractéristiques, traditions et coutumes
- Électrophorèse de fondation, technique, à quoi sert-il, exemples »

