Fonctionnement de l'électrode Calomel, caractéristiques, utilisations

- 3096
- 801
- Adrien Remy
Il Électrode de calomel O Calomelanes est une électrode secondaire qui permet de déterminer les potentiels semi-vies, grâce à la réaction qui se produit entre le mercure et le chlorure de mercure (I), HG2CL2, anciennement connu sous le nom de Calomel. Les deux réactifs, HG et HG2CL2, Ils gagnent ou perdent des électrons en fonction du milieu dans lequel l'électrode est immergée.
Normalement abrégé en EC, cette électrode remplace par de nombreuses mesures à l'électrode hydrogène standard (SHE), car elle est plus facile à construire et moins risquée à manipuler (malgré le mercure). À l'intérieur, il contient une solution de KCl en tant que milieu électrolytique pour les électrons à flux.
 Électrode de calomel en pleine mesure. Source: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons
Électrode de calomel en pleine mesure. Source: Chandrajit Karmakar, CC BY-SA 4.0, via Wikimedia Commons L'électrode de calomel peut avoir des variantes différentes en fonction de sa taille, ou plus important encore de la concentration de KCL. Lorsque la solution KCL est saturée, nous parlons d'un électro de saturado calomel (ESC). L'ESC est plus facile à préparer que la CE, mais plus sensible aux changements de température.
L'utilisation de cette électrode a permis de déterminer les potentiels semi-vie pour d'innombrables réactions redox. Il s'agit également d'un dispositif récurrent dans les déterminations potentiométriques, qui cherchent à connaître la quantité d'analyte en fonction de la cellule et du potentiel mesuré.
[TOC]
Fonctionnement
Pour que l'électrode de Calomel fonctionne, la paire Hg-hg2CL2 Vous devez réagir, que ce soit gagner ou perdre des électrons.
Cathodique
Lorsque la réduction ou le gain d'électrons se produit à l'intérieur de l'électrode de calomel, nous avons les réactions suivantes:
HG2CL2 → Hg22+ + 2Cl- (Ionisation)
HG22+ + 2E- → 2hg (réduction)
HG2CL2 + 2E- → 2hg + 2cl- (Réaction nette)
Peut vous servir: réaction exothermiquePar conséquent, le HG2CL2 Gagner des électrons réducteurs au mercure métallique.
Le potentiel de l'électrode lorsque la réduction se produit est donné par l'équation:
E = eº - 0.0591 Log [CL-]]
Où il est observé que cela dépend exclusivement de la concentration des ions CL-, étant le potentiel de réduction standard pour cette électrode mesurée devant l'électrode hydrogène standard.
Anodique
Dans l'électrode, un processus d'oxydation peut également se produire:
2hg → hg22+ + 2E- (Oxydation)
HG22+ + 2Cl- → Hg2CL2 (Précipitation)
2hg + 2cl- → Hg2CL2 + 2E- (Réaction nette)
C'est-à-dire que le mercure s'oxyde pour générer plus de Hg2CL2.
Le potentiel E dans ce cas est donné par:
E = eº + 0.0591 Log [CL-]]
Et encore, et cela dépend de [CL-]].
Réaction générale
La réaction générale de l'électrode de Calomel est:
HG2CL2(s) + 2e- ⇌ 2Hg (l) + 2cl-
Le sens de l'équilibre dépendra du milieu où l'électrode est en contact. Le CL- Déterminer la solubilité de Hg2CL2, qui à son tour a un impact sur la formation ou l'oxydation de la HG.
Et le potentiel déterminé pour une concentration spécifiée d'ions CL- Il sera égal à:
ETcalomel = Egrille - ETbœuf
Être ecalomel Le potentiel qui est rapporté comme référence dans certaines tables potentielles.
Caractéristiques de l'électrode calomel
Représentation du semi
Calomel Electrode semi -edge peut être représenté comme suit:
PT | HG | HG2CL2| CL- (Xm)
Où seule la concentration des ions CL est importante-, exprimé dans la molarité ou la normalité. Le potentiel de l'électrode variera s'il est rempli de solutions de différentes concentrations de KCL.
Par exemple, un EC avec KCL 0.1 m a un et égal à 0.3356 V à 25 ° C; Tandis que l'ESC, avec du KCl saturé, a un et égal à 0.2444 V à la même température.
Peut vous servir: isopentano: structure, propriétés, utilisations, obtentionPar conséquent, la concentration de KCL est la caractéristique la plus importante des électrodes de calomel, car elle indiquera quoi utiliser lorsque les calculs des mesures potentiométriques sont effectués.
Commercialement, trois types d'électrodes de calomel sont obtenus: saturé (ESC), le dix-neuvième (0.1 n ou 0.1 m KCl) et la normale (1 n ou 1 m KCl). Une électrode de Calomel 1 M KCL serait représentée comme:
PT | HG | HG2CL2| CL- (1 m)
Des soirées
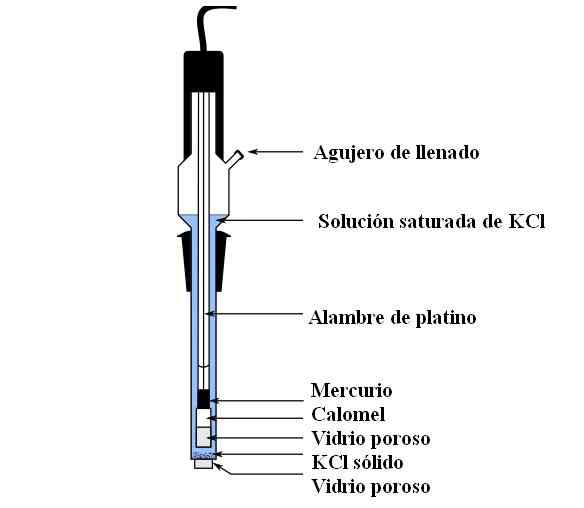 Pièces d'électrode Calomel. Source: Bachi-Bouzou, CC0, via Wikimedia Commons
Pièces d'électrode Calomel. Source: Bachi-Bouzou, CC0, via Wikimedia Commons Dans l'image supérieure, nous montrons les principales parties d'une électrode de calomel ordinaire. Il est en verre et se compose de deux conteneurs: un externe, qui est mis en contact électrochimique avec le milieu des mesures et contient la solution de KCL; Et un intérieur, où repose le mélange Hg-Hg2CL2.
En interne, l'électrode de calomel contient du mercure liquide, sur lequel une pâte Hg est adhérée2CL2 humidifié de mercure. C'est la phase la plus active de l'électrode. Le verre poreux est utilisé pour ne permettre que l'entrée ou la sortie des ions CL-, Mais pas les cristaux de HG2CL2 Ou des gouttes de mercure.
Un câble de platine, où les électrons s'écoulent, est submergé dans le mercure et est responsable de la connexion de l'électrode avec le voltmètre et le circuit externe en question.
À travers le trou de remplissage, la solution de KCL est versée, qui contient des déroulements de sel dissous. Pendant ce temps, au bas de l'électrode, nous avons une très petite ouverture dans un verre poreux, qui entre en contact direct avec le milieu des mesures. Le but du verre poreux est de permettre le contact sans échanges de substances indésirables qui contaminent l'électrode ou l'échantillon.
Il peut vous servir: Cyclohexen: structure, propriétés, synthèse et utilisationsavantage
L'électrode de calomel présente les avantages suivants en ce qui concerne l'électrode d'hydrogène standard:
-Facile à construire et à manipuler
-Son potentiel cellulaire reste constant même si l'eau s'évapore
-Vous n'avez pas besoin d'un pont saline
L'ESC est la plus facile à construire à partir d'électrodes calomel, car KCL est suffisant pour se dissoudre jusqu'à ce que leurs cristaux soient formés. Ensuite, la solution sera saturée et prête à perdre à l'intérieur de l'électrode.
Désavantages
L'électrode de Calomel présente cependant les inconvénients suivants:
-En contenant du mercure liquide, il peut exercer un impact négatif sur l'environnement
-Il ne peut pas être utilisé pour des analyses quantitatives dans des échantillons avec une température supérieure à 60 ºC, car le Hg2CL2 commence à se décomposer, provoquant l'échec des lectures d'électrode
L'ESC présente également l'inconvénient qu'il est très sensible aux changements de température.
L'électrode argentée en argent a remplacé le calomel dans de nombreuses déterminations potentiométriques.
Applications
L'électrode de Calomel est l'une des nombreuses électrodes qui sont utilisées quotidiennement dans les déterminations potentiométriques, permettant d'obtenir les potentiels semi-vies des analytes ou des espèces d'intérêt.
De plus, l'électrode de calomel est utilisée dans les mesures de pH et la voltmétrie cyclique.
Les références
- Jour, r., & Underwood, un. (1986). Chimie analytique quantitative (Fifth Ed.). Pearson Prentice Hall.
- Wikipédia. (2020). Électrode de calomel saturée. Récupéré de: dans.Wikipédia.org
- Général, Eni. (20 octobre 2018). Calomel électrode. Dictionnaire et glossaires de la chimie de l'Angleterre croate et de l'Angleterre. KTF-Split. 30 octobre. 2020. Récupéré de: Glossaire.Périodes.com
- Skoog d.POUR., Ouest D.M. (1986). L'analyse instrumentale. (Deuxième Ed.). Inter-américain., Mexique.
- Collines, g., Ives, D. T. (1950). L'électrode de calomel. Nature 165, 530 doi.org / 10.1038 / 165530A0
- Jmgav. (9 décembre 2012). Potentiométrie (ii): électrodes. Récupéré de: triplenlace.com
- « Caractéristiques de paradigme socio-critique, méthodes, représentants
- Fondamentaux de potentiométrie, équations, électrodes »

