Fondamentaux de potentiométrie, équations, électrodes

- 3314
- 1017
- Raphaël Meyer
La Potentiométrie Il s'agit d'une technique d'analyse électrochimique basée sur la mesure de la tension, d'un milieu ou d'un compartiment, avec lequel l'activité ou la concentration d'une espèce (ionique ou moléculaire) d'intérêt est déterminée. C'est une technique non destructive, car elle ne cherche pas à modifier la nature chimique de l'analyte en question.
Pour effectuer cette analyse, au moins deux électrodes sont indispensables: une référence et un autre indicateur ou travail. De même, il doit y avoir un voltmètre d'impédance élevé, avec lequel les tensions sont mesurées sans permettre un débit d'électrons appréciable entre les deux électrodes et les solutions qui les entourent.
 Représentation générale des éléments nécessaires pour une analyse potentiométrique. Source: Gabriel Bolívar.
Représentation générale des éléments nécessaires pour une analyse potentiométrique. Source: Gabriel Bolívar. Ci-dessus, nous avons une représentation générale de l'assemblée pour une analyse potentiométrique. Dans le compartiment où l'électrode d'indicateur est introduite est l'espèce dont nous voulons déterminer la concentration; Alors que dans l'électrode de référence, nous avons une autre solution, dans laquelle nous connaissons les concentrations de ses composants.
La lecture de tension enregistrée est due, en principe, aux espèces d'intérêt qui s'approchaient de l'électrode de l'indicateur. Avec cette tension, nous calculons la concentration de cette espèce, par exemple celle des ions CA2+, Agir+, H+, N / A+, K+, CL-, etc. La potentiométrie a donc des utilisations dans la chimie clinique, environnementale, analytique et physicochimique.
[TOC]
Fondamentaux
La tension déterminée dans les analyses potentiométriques est celle de la cellule, etcellule, qui est la différence entre les tensions causées par les deux électrodes, l'indicateur et la référence. Les électrodes sont sensibles aux activités des molécules ou des ions qui les entourent, en étant capable d'en accepter des électrons, ou au contraire les céder.
Les deux compartiments sont connectés, donc l'électrode électrode s'écoule où la réduction se produit (cathode), à l'électrode où l'oxydation (anode) a lieu (anode).
Cependant, ce transfert d'électrons (ou de courant) est presque nulle, car sinon les réactions redox évolueraient pour modifier complètement les concentrations et les identités des espèces impliquées.
Peut vous servir: bromure d'hydrogène (HBR)Au lieu de cela, le voltmètre permet à peine le passage des électrons, de sorte qu'il y a une lecture de tension stable, et que la cellule peut atteindre l'équilibre thermodynamique.
On dit donc que la potentiométrie est une technique non destructive, car peu d'ions ou de molécules sont transformés en processus de mesure, qui est également réversible.
Équations principales
Potentiel cellulaire
Le potentiel de la cellule est lié aux activités ou aux concentrations des espèces d'intérêt par l'équation de Nernst:
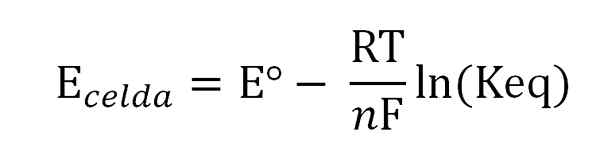 Équation de Nernst. Source: Gabriel Bolívar.
Équation de Nernst. Source: Gabriel Bolívar. Où eº est le potentiel de la même cellule dans des conditions standard, f la constante de Faraday, n Le nombre d'électrons transférés, r la constante de gaz et Keq la constante d'équilibre de la réaction globale. Les calculs sont effectués en effacant KEQ à partir de la lecture de Ecellule, et calculer la concentration souhaitée de votre expression d'équilibre.
Cependant, il est pratique de calculer les concentrations par une route plus facile. Par convention, le potentiel de la cellule est également donné par l'équation suivante:
ETcellule = Egrille- ETbœuf
Où estgrille C'est le potentiel de réduction semi-média, où se trouve l'électrode de l'indicateur; Pendant que ebœuf C'est le potentiel de semi-média d'oxydation, où nous avons l'électrode de référence. Ainsi, l'équation peut être réécrite comme:
ETcellule = Eindicateur - ETréférence + ETJ
Être eJ égal au potentiel causé par les joints de pont joint. En pratique, etJ Il ne peut pas être déterminé, mais s'assurer que sa valeur est aussi minime que possible en utilisant des solutions très diluées, ou s'assurer que les compositions dans les deux compartiments sont similaires.
Potentiel de l'analyte
De l'équation précédente, nous pouvons calculer etindicateur, ce qui est le potentiel qui nous intéresse vraiment. Avec cette valeur, nous appliquons à nouveau l'équation de Nernst:
Peut vous servir: acétonitrile (C2H3N)ETindicateur = Eº - (rt / nf) ln (rouge / ox)
Le réseau est la forme réduite de l'analyte ou des espèces d'intérêt, et le bœuf est sa forme oxydée. En supposant que l'analyte est les cations Zn2+ Sur une électrode de zinc métallique, nous aurions:
ETindicateur = EºZn2 + / Zn - (Rt / nf) ln (1 /pourZn2+)
Où pourZn2+ C'est l'activité de cation Zn2+, qui, par les ajustements expérimentaux, est assez proche de sa concentration, [Zn2+]]. De cette équation, la concentration de Zn est éliminée2+, que comme on peut le voir, affecte directement la valeur de eindicateur.
La forme réduite de zinc, Zn, présente une activité égale à 1. Par conséquent, l'équation générale des cations rouillés d'un métal qui agit comme une électrode sera égale à:
ETindicateur = EºMn + / m - (Rt / nf) ln (1 /pourM+n)
Mais cela ne s'applique que dans le cas des premières électrodes d'espèce.
Électrodes
Les électrodes, en plus du voltmètre, sont les éléments les plus importants de toute analyse potentiométrique. Certains d'entre eux seront mentionnés ci-dessous.
Première espèce
Les premières électrodes d'espèce sont des métaux qui s'oxydent pour provoquer des cations, conduisant des électrons au voltmètre. Certains d'entre eux sont les suivants: Ag, Zn, Cu, Hg, Sn, TL, CD et BI.
Tous les métaux ne servent pas d'électrodes de première classe, car elles ne devraient pas présenter d'irrégularités cristallines ou de surfaces recouvertes de couches d'oxyde qui provoquent des tensions instables.
Seconde espèce
Les électrodes de la deuxième espèce, en revanche, sont également métalliques, mais contiennent également un sel à leur surface, dont la solubilité dépend des réactions redox qui se produisent. Par exemple, les électrodes Ag-Agcl et Hg-Hg2CL2 (Calomel), sont des électrodes de deuxième espèces.
Ions sélectifs
Les électrodes d'ion sélectif, également appelées membranes, sont celles qui sont sensibles à un ion ou à une molécule spécifique, qui se faufile à travers une membrane conçue uniquement pour qu'il passe et non les autres espèces en solution.
Peut vous servir: réactif limitant et excessifL'exemple préféré de ce type d'électrode est celui du verre, construit pour déterminer la concentration d'ions H3SOIT+ ou h+, Et ainsi servir de péhomètre.
Applications de potentiométrie
Chimie environnementale
La potentiométrie a été utilisée dans la chimie environnementale dans la détermination des ions CN-, F- et non3-, ainsi que l'ammoniac dans les courants d'eau.
Chimie clinique
Les électrodes sélectives sont très utiles lorsque le support de mesure est complexe. Par conséquent, les autres ions ou molécules interféreront avec les lectures.
Cette caractéristique est particulièrement bénéfique dans les déterminations potentiométriques effectuées dans les mêmes cellules, où les microélectrodes sont injectées pour déterminer les concentrations de K k+, N / A+, CL-, CA2+ ou h+.
Degrés potentiométriques
Supposons que au milieu où nous avons l'électrode d'indicateur, un titre est ajouté qui réagit avec l'analyte et, par conséquent, il modifie sa concentration. Alors des changements se produiront dans le ecellule, qui correspondra de la même manière au changement de pH dans un titrage acide-base.
Ainsi, graphiquement etcellule contre. VTitulant, Nous pouvons déterminer le tournant ou l'équivalence, et avec cela, nous saurons la concentration de l'analyte.
Les degrés potentiométriques sont largement utilisés dans les laboratoires de chimie analytique et physicochimique. Certains des analytes qui peuvent être déterminés avec cette technique sont les suivants: Faith2+, HCO3-, CA2+, Mg2+, Cu2+, acide ascorbique, haluros, entre autres.
Tous les diplômes, dans une certaine mesure, peuvent être suivis via potentiométrique au lieu de recourir aux indicateurs et à leurs points finaux.
Les références
- Jour, r., & Underwood, un. (1986). Chimie analytique quantitative (Fifth Ed.). Pearson Prentice Hall.
- Skoog d.POUR., Ouest D.M. (1986). L'analyse instrumentale. (Deuxième Ed.). Inter-américain., Mexique.
- Docteur. Doug Stewart. (2020). Définition de la potentiométrie. Récupéré de: Chemicool.com
- Harvey David. (5 juin 2019). Méthodes en potntiométrique. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Britannica Encyclopaedia. (2020). Électrogravimétrie. Récupéré de: Britannica.com
- Wikipédia. (2020). Méthodes électroanalytiques. Récupéré de: dans.Wikipédia.org
- « Fonctionnement de l'électrode Calomel, caractéristiques, utilisations
- Stimuler les types de médicaments et leurs caractéristiques »

