Différences entre les composés organiques et inorganiques

- 4456
- 15
- Jade Duval
Le Différences entre les composés organiques et inorganiques Ils ne sont pas toujours simples, et ils obéissent à une règle immuable, car en termes de chimie, il existe des symphines d'exceptions qui contredisent ou remettent en question les connaissances antérieures. Cependant, il existe des caractéristiques qui permettent de discerner parmi de nombreux composés qui ou non.
Par définition, la chimie organique est l'étude qui comprend toutes les branches de la chimie du carbone; Par conséquent, il est logique de penser que leurs squelettes sont composés d'atomes de carbone. D'un autre côté, les squelettes inorganiques (sans pénétrer dans les polymères) sont généralement constitués de tout autre élément du tableau périodique autre que le carbone.
Les êtres vivants, sur toutes leurs échelles et expressions, sont pratiquement en carbone et autres hétéroátomos (H, O, N, P, S, etc.). Ainsi, toute la verdure qui couvre la croûte de la Terre, ainsi que les créatures qui marchent dessus, sont des exemples vivants de composés organiques entremêlés et dynamiquement.
D'un autre côté, forant la terre et dans les montagnes, nous trouvons de riches corps minéraux en composition et formes géométriques, qui dans leur grande majorité sont des composés inorganiques. Ces derniers définissent également presque entièrement l'atmosphère que nous respirons et les océans, les rivières et les lacs.
Composés organiques | Composés inorganiques | |
Atomes qui le composent | Ils contiennent des atomes de carbone. | Ils sont constitués d'éléments autres que le carbone. |
Ils font partie de .. | Font partie des êtres vivants. | Ils font partie des êtres inertes. |
Sources dans lesquelles ils sont | Ils sont moins abondants dans les sources naturelles. | Ils sont plus abondants dans des sources naturelles. |
Types de composés | Ils sont généralement moléculaires. | Ils sont généralement ioniques. |
Types de liens | Liens covalents. | Liens ioniques. |
Masses molaires | Masses molaires plus grandes. | Masses molaires inférieures. |
Diversité | Ils sont moins diversifiés. | Ce sont des éléments plus diversifiés. |
Points de fusion et d'ébullition | Points de fusion et d'ébullition mineurs. | Points de fusion et d'ébullition plus élevés. |
Principales différences entre les composés organiques et inorganiques
Les composés inorganiques sont obtenus à partir de sources naturelles plus abondantes que celles des composés inorganiques
 Crystals de sucre (à droite) et sel (à gauche) Vu au microscope. Source: Oleg Panichev [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Crystals de sucre (à droite) et sel (à gauche) Vu au microscope. Source: Oleg Panichev [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] Bien qu'il puisse y avoir des exceptions, les composés inorganiques sont généralement obtenus à partir de sources naturelles plus abondantes que celles des composés organiques. Cette première différence conduit à une déclaration indirecte: les composés inorganiques sont plus abondants (sur terre et dans le cosmos) que les composés organiques.
Bien sûr, dans un site de pétrole, les hydrocarbures et les prédominés apparentés prédomineront, qui sont des composés organiques.
Revenant à la section, il peut être mentionné au sel de sucre à titre d'exemple. Les cristaux de sucre (plus robustes et à facettes) et le sel sont illustrés ci-dessus (plus petits et arrondis).
Le sucre est obtenu, après une série de processus, des plantations de canne à sucre (dans des régions ensoleillées ou tropicales) et des betteraves de sucre (dans les régions froides ou au début des hivers ou de l'automne). Les deux sont des matières premières naturelles et renouvelables, qui sont cultivées jusqu'à leur bonne récolte.
Peut vous servir: standardisation des solutionsPendant ce temps, le sel provient d'une source beaucoup plus abondante: la mer, ou les lacs et les sels tels que Halita Mineral (NaCl). Si toutes les betteraves de canne à sucre et de sucre étaient rassemblées, elles ne pourraient jamais correspondre aux réserves de sel naturel.
Les cristaux inorganiques sont généralement ioniques tandis que les cristaux organiques ont tendance à être moléculaires
En reprenant la paire de sucre-exal à titre d'exemple, nous savons que le sucre se compose d'un disaccharide appelé saccharose, qui à son tour se désintégre en une unité de glucose et un autre de fructose. Les cristaux de sucre sont moléculaires, car ils sont définis par le saccharose et leurs ponts d'hydrogène intermoléculaires.
Pendant ce temps, les cristaux de sel constituent un réseau na ion+ et cl-, qui définissent une structure cubique centrée sur les faces (FCC).
Le point central est que les composés inorganiques forment généralement des cristaux ioniques (ou du moins, possédant un caractère ionique élevé). Cependant, il y a plusieurs exceptions, telles que les cristaux de coche2, H2S, donc2 et d'autres gaz inorganiques, qui se solidifient à basses températures et pressions élevées, et sont également moléculaires.
L'eau représente l'exception la plus importante à ce point: la glace est un cristal inorganique et moléculaire.
 Les quelques-uns de la neige ou de la glace sont des cristaux d'eau, d'excellents exemples de cristaux moléculaires inorganiques. Source: Sieverschar de Pixabay.
Les quelques-uns de la neige ou de la glace sont des cristaux d'eau, d'excellents exemples de cristaux moléculaires inorganiques. Source: Sieverschar de Pixabay. Les minéraux sont essentiellement des composés inorganiques, et leurs cristaux sont donc principalement ioniques. C'est pourquoi ce deuxième point est considéré comme valide pour un large spectre de composés inorganiques, y compris les sels, les sulfures, les oxydes, les tellos, etc.
Le type de lien qui régit dans les composés organiques est covalent
Les mêmes cristaux de sucre et de sel laissent quelque chose question: les premiers contiennent des liens covalents (directionnels), tandis que les seconds présentent des liaisons ioniques (non directionnelles) (non directionnelles).
Ce point est directement corrélé avec le second: un cristal moléculaire doit nécessairement avoir plusieurs liaisons covalentes (partageant quelques électrons entre deux atomes).
Encore une fois, les sels biologiques établissent certaines exceptions, car elles ont également un caractère fortement ionique; Par exemple, le benzoate de sodium (C6H5Pata) est un sel organique, mais à l'intérieur du benzoate et de son anneau aromatique, il y a des liaisons covalentes. Même ainsi, on dit que leurs cristaux sont ioniques compte tenu de l'interaction électrostatique: C6H5Roucouler- N / A+.
Dans les composés organiques, les liaisons covalentes entre les atomes de carbone prédominent
Ou ce qui est la même chose à dire: les composés organiques sont constitués de squelettes gazéifiés. Il y a plus d'une liaison C-C ou C-H, et ce squelette peut être linéaire, morne ou ramifié, variant dans le degré de leur insaturation et le type de substituant (hétéroaátomos ou groupes fonctionnels). En sucre, les liens C-C, C-H et C-OH abondent.
Il peut vous servir: réduction de l'agent: concept, les plus forts, des exemplesPrenons comme exemple le co, ch2Och2 et h2C2SOIT4. Lequel de ces trois composés est inorganique?
Pouce2Och2 (dioxyde d'éthylène) Il y a quatre liaisons C-H et deux liaisons C-O, tandis que dans H2C2SOIT4 (acide oxalique) Il y a un c-c, deux c-oh et deux c = o. La structure de H2C2SOIT4 Il peut être écrit comme HOOC-COOH (deux groupes carboxyles liés). En attendant, le CO se compose d'une molécule généralement représentée avec une liaison hybride entre C = O et C≡O.
Étant donné que dans le CO (monoxyde de carbone), il n'y a qu'un atome de carbone lié à celui de l'oxygène, ce gaz est inorganique; Les autres composés sont organiques.
Les composés organiques ont généralement des masses molaires plus grandes
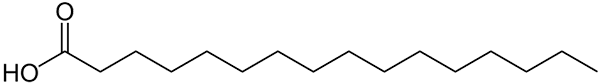 Structure représentée avec des lignes d'acide palmitique. La grande chose qui est comparée aux petits composés inorganiques, ou le poids de la formule de ses sels peut être remarqué. Source: Wolfgang Schaefer [domaine public]
Structure représentée avec des lignes d'acide palmitique. La grande chose qui est comparée aux petits composés inorganiques, ou le poids de la formule de ses sels peut être remarqué. Source: Wolfgang Schaefer [domaine public] Encore une fois, il existe de nombreuses exceptions à ces règles, mais généralement les composés organiques ont tendance à avoir des masses molaires plus grandes en raison de leur squelette gazéifié.
Par exemple, les molaires des composés ci-dessus sont: 28 g / mol (CO), 90 g / mol (H2C2SOIT4) et 60 g / mol (choisissez2Och2). Bien sûr, le CS2 (Disulfure de carbone), composé inorganique et dont la masse molaire est de 76 g / mol, "pèse" plus que Cho2Och2.
Mais qu'en est-il des graisses ou des acides gras? De biomolécules telles que l'ADN ou les protéines? Ou d'hydrocarbures de chaîne linéaire étendus? Ou asphaltène? Ses masses molaires dépassent facilement 100 g / mol. L'acide palmitique (image supérieure), par exemple, a une pâte molaire de 256 g / mol.
Les composés organiques sont plus abondants
Certains composés inorganiques, appelés complexes de coordination, présentent Isomeía. Cependant, cela est moins diversifié par rapport à l'isoméria organique.
Même si nous ajoutons tous les sels, oxydes (métalliques et non métalliques), sulfures, téléluros, carbures, hydrures, nitrures, etc., Nous ne rassemblerions pas peut-être même la moitié des composés organiques qui peuvent exister dans la nature. Par conséquent, les composés organiques sont plus abondants en nombre et plus riches en structures.
Les composés inorganiques sont plus diversifiés
Cependant, selon la diversité élémentaire, les composés inorganiques sont plus variés. Parce que? Parce qu'avec le tableau périodique dans la main, vous pouvez construire tout type de composé inorganique; Alors qu'un composé organique est limité uniquement aux éléments: C, H, O, P, S, N et X (halogènes).
Nous avons de nombreux métaux (alcalins, alcalineurs, transition, lanthanides, actinides, ceux du bloc P) et infinités d'options pour les combiner avec plusieurs anions (inorganique ordinaire); comme: CO32- (Carbonates), CL- (Chlorures), p3- (phosphouros), ou2- (oxydes), oh- (hydroxydes), donc42- (sulfates), CN- (Cyanides), SCN- (Tiocianates), et bien d'autres.
Notez que les anions CN- et SCN- Ils semblent être biologiques, mais ils sont en fait inorganiques. Une autre confusion est l'anion oxalate, C2SOIT42-, qui est organique et non inorganique.
Peut vous servir: règle diagonaleLes composés inorganiques ont des points de fusion et d'ébullition plus élevés
Encore une fois, il y a plusieurs exceptions à cette règle, car tout dépend de la paire de composés comparés. Cependant, en collant aux sels inorganiques et biologiques, les premiers ont généralement plus de points de fusion et d'ébullition que le second.
Ici, nous trouvons un autre point implicite: les sels biologiques sont susceptibles de décomposer, car la chaleur brise ses liaisons covalentes. Néanmoins, nous comparons le tartrato calcique par (CAC4H4SOIT6) et le carbonate de calcium (Caco3). Le cac4H4SOIT6 Il se décompose à 600 ° C, tandis que le caco3 Il fond à 825 ° C.
Et que le caco3 est loin d'être l'un des sels avec les points de fusion les plus élevés, comme dans les cas du CAC2 (2160 ºC) et CAS2 (2525 ºC): carburo et sulfure de calcium, respectivement.
Les composés organiques sont plus rares dans l'univers
Les composés organiques les plus simples et les plus primitifs, comme le méthane, le cho4, Urée, CO (NH2)2, ou la glycina d'acide aminé, NH2Ch2COOH, sont des espèces très rares dans le cosmos par rapport à l'ammoniac, au dioxyde de carbone, aux oxydes de titane, au charbon, etc. Dans l'univers, même les matériaux précurseurs de la vie ne sont pas souvent détectés.
Les composés organiques soutiennent la vie à un degré beaucoup plus élevé que
 La coquille d'un Morrocoy se compose d'un mélange d'os couverts de kératine, composés d'une matrice inorganique (hydroxyapatite et minéraux apparentés) et organique (collagène, cartilage et nerfs). Source: Morrocoy_ (Geochelone_carbonary).JPG: La photographie.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
La coquille d'un Morrocoy se compose d'un mélange d'os couverts de kératine, composés d'une matrice inorganique (hydroxyapatite et minéraux apparentés) et organique (collagène, cartilage et nerfs). Source: Morrocoy_ (Geochelone_carbonary).JPG: La photographie.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] La chimie du carbone, organique, appliquée dans la compréhension des processus métaboliques, devient biochimie (et du point de vue des cations métalliques, en bioinorganique).
Les composés organiques sont la pierre angulaire de la vie (comme le Morrocoy de l'image supérieure), grâce aux liens C-C et à l'énorme conglomérat de structures résultant de ces liens, et à son interaction avec les cristaux de sels inorganiques.
De retour à la paire de sucre-sel, les sources naturelles de sucre sont vivantes: ce sont des cultures qui se développent et meurent; Mais cela ne se produit pas de la même manière avec les sources du sel: les mers ou les dépôts salins sont vivants (au sens physiologique).
Les plantes et les animaux synthétisent des composés organiques sans fin, qui intègrent une vaste gamme de produits naturels (vitamines, enzymes, hormones, graisses, colorants, etc.).
Cependant, nous ne pouvons pas laisser de côté le fait que l'eau est le solvant de la vie (et est inorganique); Ni que l'oxygène est indispensable à la respiration cellulaire (sans nommer des cofacteurs métalliques, qui ne sont pas des composés inorganiques mais des cations). Par conséquent, Inorganic joue également un rôle crucial dans la définition de la vie.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Helmestine, Anne Marie, Ph.D. (3 juillet 2019). La différence entre organique et inorganique. Récupéré de: Thoughtco.com
- Texas Education Agency. (2019). Biologique ou inorganique? Récupéré de: Texasgateway.org
- Saccharose. (s.F.). Comment le sucre est fabriqué: une introduction. Récupéré de: Sucrosa.com
- Wikipédia. (2019). Liste des composés inorganiques. Récupéré de: dans.Wikipédia.org
- « Différences entre la vitesse et la vitesse (avec des exemples)
- 10 Dynamique de l'intelligence émotionnelle pour les enfants et les adultes »

