Comment le modèle Brönsted-Lowry complète-t-il le modèle Arrhenius?
- 2641
- 400
- Paul Dumas
 Brönsted et Lowry ont complété le modèle d'Arrhenius élargissant les concepts de substances acides et de substances de base
Brönsted et Lowry ont complété le modèle d'Arrhenius élargissant les concepts de substances acides et de substances de base Quels sont les modèles Brönsted-Lowry et Arrhenius?
Le modèle d'Arrhenius et Brönsted-Lowry décrivent deux types de substances très importantes: les acides et les bases. Les deux participent à des processus biologiques et font partie de médicaments et de composés utiles.
Les acides ont un goût aigre caractéristique, tandis que les bases ressentent des savons au toucher. Pendant longtemps, ces différences sensorielles étaient celles qui ont aidé à les distinguer, jusqu'à ce que le chimiste suédois Svante Arrhenius (1859-1927), à la fin du 19e siècle, a établi quantitativement la distinction.
Le modèle d'Arrhenius-base Arrhenius déclare qu'une substance est:
- Acide, Si vous libérez des protons (ions hydrogène H+) ou des ions hydronio3SOIT+ En solution aqueuse.
- Base, Lors de la production d'ions hydroxyde (oh-), également en solution aqueuse.
Cette définition est limitée uniquement aux solutions aqueuses. Par conséquent, il n'explique pas comment d'autres substances se comportent également comme des acides ou des bases, même sans être dissous dans l'eau ou ne contiennent pas d'ions hydrogène ou hydroxyde.
Par conséquent, deux chimistes, un danois, nommé Johannes Brönsted (1879-1949) et un autre anglais, Thomas Lowry (1874-1936), élargis indépendamment les définitions d'Arrhenius, pour inclure des cas non envisagés par ce.
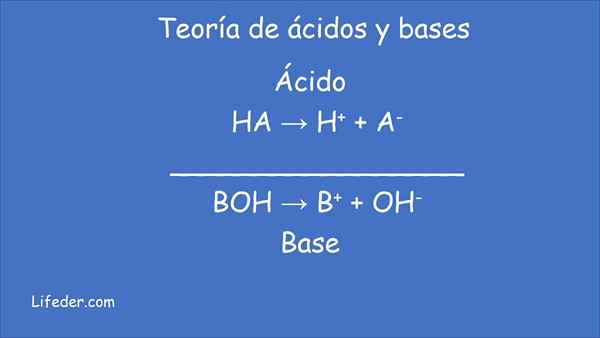
Selon la nouvelle théorie, la définition des acides et des bases est la suivante:
- Acide C'est toute espèce chimique qui donne des protons (ions hydrogène H+) à une autre substance.
- Base, Espèces chimiques qui acceptent les protons (ions hydrogène H+) d'une autre substance.
 Le bicarbonate de soude est une base et du vinaigre, un acide. Lors de la réaction, des bulles de dioxyde de carbone sont produites, un sel de sel et d'eau sel et l'eau. Source: Wikimedia Commons
Le bicarbonate de soude est une base et du vinaigre, un acide. Lors de la réaction, des bulles de dioxyde de carbone sont produites, un sel de sel et d'eau sel et l'eau. Source: Wikimedia Commons Modèle d'Arrhenius
Dans sa thèse de doctorat, Svante Arrhenius a élaboré une théorie sur le Dissociation électrolytique. Selon cela, il existe des substances qui présentent une conductivité électrique lorsqu'ils sont dans une solution aqueuse, c'est-à-dire qu'ils conduisent l'électricité.
Peut vous servir: acides et bases dans la vie quotidienne: réactions, utilisations, exemplesCes substances sont électrolytes. Exemple d'entre eux est le sel commun, ou chlorure de sodium, dissous dans l'eau, qui produit ions (espèces chimiques avec charge nette) dans la solution.
Dans le cas du chlorure de sodium dans l'eau, la réaction correspondante est:
NaCl → Na+ + CL-
De même, pour une base telle que l'hydroxyde de sodium NaOH, en solution aqueuse, la dissociation électrolytique est:
NaOH → Na+ + Oh-
Et pour un acide, également en solution aqueuse, comme l'acide chlorhydrique HCL, vous avez:
HCL → CL- + H+
Le comportement des électrolytes en solution aqueuse a conduit Arrhenius à classer les substances comme acide qui, lorsqu'ils sont dissous dans l'eau, libèrent des protons et comme bases, auxquels les ions libèrent oh-. Par conséquent, ils sont appelés respectivement les acides et les bases d'Arrhenius.
L'avantage de cette théorie est révélé dans les réactions de neutralisation, dans lesquelles un acide et une base de base sont combinés. Dans le processus, les ions caractéristiques de chaque type de substance disparaissent, h+ En acides et oh- Dans les bases, qui produisent de l'eau.
Par exemple, le mélange d'une solution aqueuse d'acide chlorhydrique HCL avec un hydroxyde de sodium NaOH, est un exemple typique de réaction de neutralisation:
HCl + NaOH → NaCl + H2SOIT
La réaction entre un acide et une base de base, produit un sel plus d'eau, originaire de la réaction entre les ions H+ et oh-.
Limites du modèle Arrhenius
Le modèle Arrhenius était innovant pour être le premier à offrir une définition quantitative de l'acide et de la base.
Peut vous servir: changements physiquesAuparavant, la distinction entre un type de substance doit être effectuée à l'aide des sens: si une substance est amer, comme le jus de citron ou le vinaigre, c'est un acide; S'il est glissant ou savonneux, c'est une base.
Arrhenius a établi que les acides contiennent de l'hydrogène qui, lors de la dissolution dans l'eau, augmente la concentration d'ions hydrogène ou de protons d'eau pure. D'un autre côté, en dissolvant une base, la concentration d'Oo ion augmente-.
Cependant, le modèle a des limites importantes:
-Le concept d'acide et de base n'est appliqué que dans des solutions aqueuses, mais il est connu qu'il existe d'autres substances capables de se comporter comme l'un ou l'autre, même en l'absence d'eau.
-Il y a des acides qui ne contiennent pas d'hydrogène (par exemple, CO2 Et ainsi3) et bases sans ions hydroxyde (comme l'ammoniac).
-En pratique, les ions hydrogène ou les protons, chargés positivement, ne restent pas libres dans la solution. Ils attirent électriquement les molécules d'eau, qui sont polaires, provoquant des ions hydronium3SOIT+.
Modèle de Brönsted-Lowry
Les limitations de la base acide-base d'Arrhenius ont rendu nécessaire l'élargissement des concepts. Par conséquent, en 1923, Johannes Brönsted et Thomas Lowry ont accepté, indépendamment et presque en même temps, que l'acide ou le caractère de base d'une substance est donné par sa capacité à céder ou à accepter des protons.
De cette façon, les réactions de neutralisation consistent simplement en un transfert de protons entre l'acide et la base. Le premier est capable de donner des protons, et le second est prêt à les accepter.
Schématiquement, la réaction de neutralisation serait comme ceci:
Acide1 + Base2 → acide2 + Base1
Acides et bases Brönsted-Lowry
En comparant la définition de l'acide donnée par chaque modèle, il est conclu que les acides Arrhenius sont également des acides Brönsted-Lowry. Mais il sera rappelé qu'il y a des substances, comme l'ammoniac, qui se dissolvent dans l'eau se comporter comme une base, même sans avoir des ions d'hydroxyde.
Peut vous servir: Hydroxyde de mercure: structure, propriétés, utilisations, risquesAvec la définition de Brönsted-Lowry, le comportement de base de l'ammoniac dans l'eau est expliqué parce que la molécule d'ammoniac NH3 Accepter un ion h+ de l'eau, et cela se comporte comme un acide brönsted-lowry.
La réaction de l'ammoniac et de l'eau, en solution aqueuse, est:
NH3 + H2Ou ⇔ nh4+ + Oh-
La double flèche signifie que la réaction est réversible.
De cette façon, le modèle Brönsted-Lowry complète celui d'Arrhenius, y compris des cas qui, à l'origine, n'envisageaient pas.
Substances amphotentes
L'eau se comporte comme l'acide de Brönsted-Lowry lorsqu'il réagit avec une solution d'ammoniac, mais il est également capable de se comporter comme une base de Brönsted-Lowry, comme dans la réaction suivante, entre l'acide chlorhydrique et l'eau:
HCL + H2O → H3SOIT+ + CL-
Lorsqu'une substance a un double comportement, c'est-à-dire qu'elle peut être acide ou base en fonction du composé avec lequel il réagit, il est appelé Amphothera.
Les autres substances amphotentes, en plus de l'eau, sont l'ion bicarbonate et les acides aminés.
Les références
- Acides et bases. Récupéré de: fq.Iespm.est.
- Atkins, P. (2007). Principes de chimie. 3e. Édition. Pan -American Medical Editorial.
- Chang, R. (2013). Chimie. 11va. Édition. McGraw Hill.
- Académie Khan. Acides et bases de lowry brronsted.
- Ripoll, E. Acides et bases. Projet Descartes. Récupéré de: projectoScartes.org.

