Caractéristiques de la cystéine, structure, fonctions, biosynthèse
- 4862
- 241
- Raphaël Charles
La Cystéine (Cys, C) est l'un des 22 acides aminés trouvés dans la nature dans le cadre des chaînes polypeptidiques qui composent les protéines des êtres vivants. Il est essentiel pour la stabilité des structures tertiaires des protéines, car elle aide à la formation de ponts disulfure intramoléculaires.
En outre, il est vrai pour d'autres acides aminés tels que l'alanine, l'arginine, l'asparagine, le glutamate et la glutamine, la glycine, la proline, la sérine et la tyrosine, les êtres humains sont capables de synthétiser la cystéine, donc ce n'est pas considéré comme un aminé d'acide aminé essentiel.
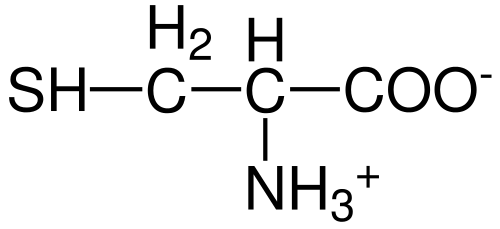
 Structure des acides aminés cystéine (Source: Hattrich [Domaine public] via Wikimedia Commons)
Structure des acides aminés cystéine (Source: Hattrich [Domaine public] via Wikimedia Commons) Malgré cela, et compte tenu du fait que les taux de synthèse ne fournissent pas toujours les exigences du corps, certains auteurs décrivent la cystéine comme un acide aminé "conditionnellement" essentiellement ".
Cet acide aminé a été nommé par la "Cystina", une composante des calculs vésiculaires découverts en 1810, dont le nom a été inventé en 1832 par un. Baudrimont et f. Malaguti. Quelques années plus tard, en 1884, et. Baumann a découvert que la cystéine était le produit de la réduction de la cystine.
Après les travaux effectués par Bauman, en 1899, il a été déterminé que la cystéine est le principal constituant de la protéine qui forme les cornes de divers animaux, ce qui a suggéré son utilisation possible pour la synthèse des polypeptides.
À l'heure actuelle, il est connu que la cystéine corporelle provient de la nourriture, du recyclage des protéines et de la synthèse endogène, qui se produit principalement dans les hépatocytes.
[TOC]
Caractéristiques
La cystéine a un poids moléculaire de 121.16 g / mol et se trouve, avec la leucine, l'isoleucine, la valine, la phénylalanine, le tryptophane, la méthionine et la tyrosine, parmi les acides aminés les plus hydrophobes.
Il appartient au groupe d'acides aminés polaires sans charge et, comme d'autres acides aminés, il peut être dégradé par une hydrolyse alcaline à des températures élevées.
Comme le tryptophane, la sérine, la glycine et la tréonine, la cystéine est un précurseur métabolique pour la gluconéogenèse et la kétogenèse (formation de cétone).
Cet acide aminé existe dans le cadre de la séquence peptidique des protéines, mais peut également être libre dans le plasma sanguin sous forme de disulfures homogènes (cystine, dérivé) ou mélangées, composées de la forme de l'homocystéine-cystéine.
La principale différence entre la cystéine libre et celle trouvée dans la structure des protéines est que le premier est dans un état redox très rouillé, tandis que le dernier est généralement assez réduit.
Structure
Comme pour le reste des acides aminés décrits à ce jour, la cystéine a un atome de carbone central, qui est chiral et est connu sous le nom de carbone α.
Quatre espèces chimiques différentes sont jointes à cet atome de carbone:
- Un groupe amino (-nh3 +)
- Un groupe carboxyle (-co-)
- un atome d'hydrogène et
- Un substituant (-r).
Le groupe substituant est celui qui donne l'identité à chaque acide aminé et celui de la cystéine est caractérisé par contenant un atome de soufre dans le cadre d'un groupe Tiol soit Sulfhydrillo (-Ch2-sh).

C'est ce groupe qui lui permet de participer à la formation de ponts disulfure intra-intermoléculaires. Puisqu'il s'agit d'un nucléophile, vous pouvez également participer à des réactions de substitution.
En fait, cette chaîne latérale de la cystéine peut être modifiée pour la formation de deux composés appelés "sélénocystéine" et "lantionine". Le premier est un acide aminé qui participe également à la formation de protéines et le second est un dérivé d'acides aminés non protéine.
Peut vous servir: Histones: caractéristiques, structure, types et fonctionsLe groupe de cystéine Tiol se caractérise également par sa grande affinité avec les ions argentés et mercure (Ag + et Hg2 +).
Les fonctions
Les principales fonctions de la cystéine dans les organismes vivants ont à voir avec leur participation à la formation des protéines. Plus précisément, la cystéine participe à l'établissement de ponts disulfure, qui sont essentiels à la formation d'une structure protéique tertiaire.
De plus, cet acide aminé est non seulement utile pour la synthèse des protéines, mais participe également à la synthèse du glutathion (GSH) et fournit un soufre réduit pour la méthionine, l'acide lipoïque, la thiamine, le coenzyme A (COA), la molybdoptère (un cofacteur) et d'autres composés ayant une importance biologique.
Dans des conditions d'une quantité excessive d'acides aminés sulfurisés, de la cystéine et d'autres acides aminés apparentés peut être utilisé pour la production de pyruvate inorganique et de soufre. Pyruvate parvient à être redirigé vers la route gluconéogène, servant une production de glucose.
Les kératines, qui sont l'un des types les plus abondants de protéines structurelles du règne animal, sont riches en résidus de cystéine. Par exemple, la laine de mouton contient plus de 4% de soufre de cet acide aminé.
La cystéine participe également à de nombreuses réactions de réduction de l'oxyde, il fait donc partie du site actif de certaines enzymes.
Lorsqu'il réagit avec le glucose, cet acide aminé génère des produits de réaction qui introduisent des goûts et des arômes attrayants dans certaines préparations culinaires.
Biosynthèse
La biosynthèse des acides aminés dans le corps humain et dans celle des autres animaux (mammifères et non-mammifères) se déroule sous forme de tissu et de classe cellulaire; C'est un processus qui mérite de l'énergie et est généralement séparé entre différents organes.
Le foie est l'un des principaux organes impliqués dans la synthèse de la plupart des acides aminés non essentiels, quelles que soient les espèces considérées.
En cela, non seulement la cystéine est synthétisée, mais aussi aspartate, asparagine, glutamate et glutamine, glycine, sérine, tyrosine et autres de ses précurseurs d'acides aminés spécifiques.
En 1935, la marque Erwin a déterminé que la cystéine, chez les mammifères, est naturellement synthétisée à partir de la méthionine, qui se déroule exclusivement dans les tissus du foie.
Ce processus peut se produire en raison d'un "transmétile" de méthionine, où les groupes méthyle sont transférés sur la colline et la créatine. Cependant, la cystéine peut également être formée à partir de la métification grâce à une transulfuration.
Par la suite, il a été démontré que, en plus de la métification, certains composés synthétiques tels que la N-acétyl cystéine, la cystéamine et la cystamine, sont des précurseurs utiles pour la synthèse de la cystéine.
Dans le cas de la N-acétyl cystéine, cela est pris par les cellules, où il est converti en cystéine par une enzyme du cytosol dans le cytosol.
Mécanisme de synthèse
Le mécanisme de synthèse de la cystéine de la méthodin la plus connue est celle du trans-ululo. Cela se produit principalement dans le foie, mais il a également été déterminé dans l'intestin et le pancréas.
Cela se produit à partir de l'homocystéine, un composé dérivé de la méthodin d'acide aminé; Et la première réaction de cette voie biosynthétique est une condensation catalysée par l'enzyme cistationine β-sentase (CBS) (CBS) (CBS).
Peut vous servir: uracile: structure, fonctions, propriétés, synthèseCette enzyme représente le passage de "l'engagement" de l'itinéraire et condense une homocystéine avec un résidu sérine, une autre acide aminé protéique, qui produit de la cystationin. Par la suite, ce composé est "coupé" ou "divisé" par l'enzyme Cistationasa, qui conduit à la libération de cystéine.
La régulation de l'activité enzymatique CBS est médiée par la disponibilité de la méthodin et par l'état redox de la cellule où ce processus se produit.
Grâce à la route de synthèse de la cystéine, les cellules peuvent gérer une méthodin excessive, car leur conversion en cystéine est un processus irréversible.
Synthèse de la cystéine dans les plantes et les micro-organismes
Dans ces organismes, la cystéine est synthétisée principalement à partir du soufre inorganique, qui est la source la plus abondante de soufre utilisable dans la biosphère aérobie.
Ceci est pris, pénètre dans les cellules et est ensuite réduit en sulfure (S2-), qui est incorporé dans la cystéine d'une manière similaire à ce qui se passe avec l'ammonium dans la synthèse du glutamate ou de la glutamine.
Métabolisme et dégradation
La cystéine du catabolisme survient principalement dans les cellules hépatiques (hépatocytes), bien qu'elle puisse également se produire dans d'autres types de cellules telles que les neurones, les cellules endothéliales et les cellules musculaires lisses du système vasculaire corporel.
Certains défauts du catabolisme de la cystéine produisent une maladie héréditaire connue sous le nom de «cystinurie», caractérisée par la présence de calculs de cystine dans les reins, la vessie et l'uretère.
La cystine est un acide aminé dérivé de la cystéine et les calculs sont formés par l'union de deux molécules à travers leurs atomes de soufre.
Une partie du métabolisme de la cystéine se traduit par la formation d'acide scientifique, à partir de laquelle la corrida, un acide aminé non protéique se forme. La réaction est catalysée par l'enzyme de dioxigénasa cystéine.
De plus, la cystéine peut être oxydée par le formaldéhyde pour produire de la cystéine de N-formel, dont le traitement ultérieur peut conduire à la formation de «marchandises» (produit de la condensation des cystéines avec des composés aromatiques).
Chez les animaux, la cystéine est également utilisée, ainsi que le glutamate et la glutamine, pour la synthèse de la coenzyme A, du glutathion (GSH), du pyruvate, du sulfate et de l'acide sulfidérique.
L'une des méthodes de conversion de la cystéine en pyruvate se produit en deux étapes: la première implique l'élimination de l'atome de soufre et la seconde une réaction de transamination.
Les reins sont responsables de l'excrétion des sulfates et des sulfites dérivés du métabolisme des composés de soufre tels que la cystéine, tandis que les poumons expirent le dioxyde de soufre et l'acide sulhidrique.
Glutathion
Glutathion, une molécule formée par trois déchets d'acides aminés (glycine, glutamate et cystéine) est une molécule qui est présente chez les plantes, les animaux et les bactéries.
Il a des propriétés spéciales qui en font un excellent «tampon» redox, car il protège les cellules de différents types de stress oxydatif.
Aliments riches en cystéine
La cystéine se trouve naturellement dans les aliments qui contient du soufre comme les jaunes (jaunes) des œufs, des poivrons rouges, de l'ail, des oignons, du brocoli, du chou-fleur, des collifleur, des collils et des choles de Bruxelles, des clics et des feuilles de moutarde.
Il est également présent principalement dans les aliments riches en protéines tels que les viandes, les légumineuses et les produits laitiers, parmi lesquels sont:
Peut vous servir: ovalbumine: structure, fonctions, dénaturation- Viande de vache, porc, poulet et poisson
- Avoine et lentilles
- Graines de tournesol
- Yaourt et fromage
Avantages de la consommation de cystéine
Il est considéré que son apport empêche la perte de cheveux et stimule sa croissance. Dans l'industrie alimentaire, il est très utilisé comme agent de massage panifiable et aussi pour «reproduire» les saveurs de type chair.
D'autres auteurs ont souligné que la consommation de compléments alimentaires ou d'aliments alimentaires diminue.
Certains suppléments nutritionnels liés à la cystéine sont utilisés par les êtres humains comme antioxydants, qui sont considérés comme bénéfiques du point de vue du "retard" du vieillissement.
La n-acétyl cystéine (un précurseur de la synthèse de la cystéine), par exemple, est considérée comme un supplément nutritionnel, car cela entraîne une augmentation de la biosynthèse du glutathion (GSH).
Maladies connexes
Il existe des publications scientifiques qui relient des niveaux élevés de cystéine plasmatique avec l'obésité et d'autres pathologies connexes telles que les maladies cardiovasculaires et d'autres syndromes métaboliques.
La cystinurie, comme mentionné ci-dessus, est une pathologie liée à la présence de pierres de cystine, une dérivée zip, due à un défaut génétique dans la réabsorption des acides aminés dibasiques tels que la cystine.
Troubles de la carence
La carence en cystéine est liée au stress oxydatif, car c'est l'un des principaux précurseurs de la synthèse du glutathion. Par conséquent, les lacunes dans cet acide aminé peuvent entraîner un vieillissement prématuré et tous les appartements que cela signifie.
Il a été démontré expérimentalement que la supplémentation en cystéine améliore les fonctions du muscle squelettique, diminue la relation entre les graisses et la masse corporelle non gras, diminue les taux plasmatiques de cytokines inflammatoires, améliore les fonctions du système immunitaire, etc.
Au milieu des années 1990, certaines études suggèrent que le syndrome de l'immunodéficience acquise (SIDA) pourrait être une conséquence d'une carence en cystéine induite par un virus.
Ces déclarations ont été étayées par le fait que les patients haute positif examinés avaient de faibles niveaux de cystine plasmatique et de cystéine, en plus d'une réduction des concentrations intracellulaires de glutathion.
Les références
- Dröge, W. (1993). Déficity de cystéine et de glutathion chez les patients atteints du SIDA: une justification du traitement avec la N-acyicyl-cystéine. Pharmacologie, 46, 61-65.
- Dröge, W. (2005). Stress oxydatif et vieillissement: vieillit un syndrome de défiance cystéine? Transactions philosophiques de la Royal Society B: Sciences biologiques, 360(1464), 2355-2372.
- Elshorbagy, un. K., Smith, un. D., Kozich, V., & Refsum, h. (2011). Cystéine et obésité. Obésité, vingt(3), 1-9.
- Kridich, n. (2013). Biosynthèse de la cystéine. Ecosal Plus, 1-30.
- McPherson, R. POUR., & Hardy, G. (2011). Avantages cliniques et nutritionnels des suppléments de protéines enrichies par la cystéine. Opinion actuelle en nutrition clinique et en soins métaboliques, 14, 562-568.
- Mokhtari, v., Afsharian, P., Shahhoseini, m., Kalantar, s. M., & Moini, un. (2017). Une revue sur diverses utilisations de la n-acétyl cystéine. Revue cellulaire, 19(1), 11-17.
- Piste, p. (2013). Antioxydant de la cystéine-master. Journal international des sciences pharmaceutiques, chimiques et biologiques, 3(1), 143-149.
- Quig, D. (1998). Métabolisme de la cystéine et toxicité des métaux. Revue de médecine alternative, 3(4), 262-270.
- Wu, g. (2013). Acides aminino. Biochimie et nutrition. Boca Raton, FL: Taylor & Francis Group.
- « Caractéristiques d'apprentissage social, théorie de Bandura, exemples
- Dimensions de l'éducation socio-émotionnelle, importance, école maternelle »

