Acide silícique
- 2994
- 605
- Lucas Schneider
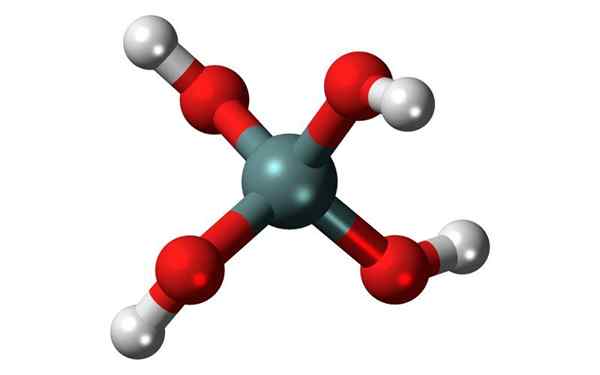
 Structure chimique de l'acide orthosylique, la plus fréquente des Sonnons. Source: Jynto, CC0, Wikimedia Commons
Structure chimique de l'acide orthosylique, la plus fréquente des Sonnons. Source: Jynto, CC0, Wikimedia Commons Qu'est-ce que l'acide silicique?
Il Acide silícique C'est une forme hydratée d'oxyde de silicium. C'est le nom général de la famille des composés chimiques formés par le silicium, attaché à des groupes d'oxyde ou d'hydroxyle.
La formule générale de ces acides est [sioX(OH)4-2x]]n, Et la manière la plus courante dont on trouve généralement celle de l'acide orthosyllique, H4Sio4.
L'acide silícique fait partie de la famille des silicates divers. Cela signifie que le plus grand oxoanion métallique est le silicate et qu'aucun atome non métallique n'est uni.
Il y a des cas isolés dans lesquels ils ont un atome non métallique, mais jamais plus d'un.
Propriétés physiques de l'acide silícique
- L'acide silícique n'existe que dans deux États, amorphes et cristallins. Le premier est obtenu par un processus de précipitation, et le second est présenté sous forme de cristal de roche.
- Acide silícique, sous sa forme amorphe (sio3), est blanc, sans saveur, insoluble dans l'eau et ne se forme pas avec des molécules de moi-même toute masse cohésive en plastique, comme avec l'aluminium.
- Dans son état cristallin, il n'est dissous par aucun oxacide. Lorsqu'une solution très diluée de solution de silice est traitée avec de l'acide sulfurique, nitrique ou chlorhydrique, l'acide silicique n'est pas précipité. Au lieu de cela, il semble être dissous dans l'eau comme un hydrate.
- Lorsqu'une solution acide ou acide à une solution de silicate est ajoutée, l'hydrate est précipité sous une forme en gelé.
Peut vous servir: acide soufréRéactions chimiques
L'acide silícique est extrêmement faible et ne perd son premier proton que lors de l'approche du pH 10. Seules 3 réactions avec cet acide sont connues dans les conditions physiologiques normales de la vie.
- La réaction avec elle-même, lorsque la solubilité est dépassée pour former une hydrate de silice amorphe.
- Sa réaction avec l'hydroxyde d'aluminium pour former un hydroxyde de silicate en aluminium.
- Molibdato excès de réaction pour former des hétéropolyhacides, tels que le silicomolibdato.
Où est l'acide silicique?
Après l'oxygène, le silicium est l'élément le plus courant de la nature. C'est sous forme de cristaux. Quand il est dans un environnement aqueux, il devient non ionisant, donc le sel de silicium en silicium.
Des approvisionnements nets d'acide silicique dans l'océan mondial ont été trouvés à 6,1 ± 2,0 terramoles de silicium par an (1 terramol = 1012 moles). Près de 80% de cette contribution provient des rivières, dont la concentration moyenne mondiale est de 150 micromolaires (concentration en eau).
Dans les sédiments marins modernes, les rendements nets du silicium biogénique (transformation du silicate dissous dans le matériau squelettique en particules) est de 7.1 ± 1.8 téramoles par an.
La production de silice biogénique de Bruta dans les eaux de surface est de 240 ± 40 terramoles de silicium par an, et le rapport de préservation (accumulation d'opales dans les sédiments / production brute dans les eaux de surface) est de 3%.
Dans la flore, on peut trouver sur la plante Borago officinalis (Borage), qui, dans sa composition, présente jusqu'à 2,2% d'acide silicique.
Peut vous servir: acétate de sodium: structure, propriétés, synthèse, utilisationsL'acide orthosylique est la forme la plus courante d'acide silicique, qui peut être trouvée à différents endroits. Les plus grandes sources biodisponibles de cet acide se trouvent dans l'eau, soit dans l'eau de mer, soit dans d'autres boissons, comme la bière.
Pour obtenir le laboratoire, le même principe est suivi que dans l'océan: il peut être obtenu par l'acidification du silicate de sodium dans une solution aqueuse.
Utilisations dans la vie quotidienne
Dentifrice
C'est le gel abrasif utilisé dans le dentifrice, ou dans la partie claire de la pâte dentaire Rayada, car en combinaison avec le carbonate de calcium, il aide à retirer la plaque en toute sécurité avec un brossage.
Il est enregistré comme un composé sûr dans la Food & Drug Administration des États-Unis et n'a pas de toxicité ou de cancérogénicité connue.
Dessicant
Lorsqu'il est séché dans un four, il perd de l'eau et devient un dessiccant (substance qui attire l'air de l'air). Par conséquent, vous pouvez trouver de petits paquets de cristaux de gel de silice dans des récipients dont le contenu peut être endommagé par l'humidité, tels que des bouteilles de vitamines, électroniques, des chaussures ou des produits en cuir.
Autres utilisations
Il peut être trouvé dans des magasins-cadeaux tels que des pierres magiques, un jardin chimique ou un jardin en verre. Sa forme sèche est mélangée avec des sels de différents métaux.
Lorsque vous jetez dans l'eau, le sodium est remplacé par le métal, et comme le silicate de métal n'est pas soluble dans l'eau, un précipité de la couleur caractéristique du métal est formé. Le silicate métallique se développe également sous forme de gel et se développe sous forme de stalagmites colorées dans l'eau.
Il peut vous servir: Hydroxyde de nickel (iii): structure, propriétés, utilisations, risquesAvantages médicaux de l'acide orthosyllique (OSA)
L'acide orthosylique est le meilleur silicium biodisponable pour l'homme. Ceci peut être utilisé pour traiter plusieurs problèmes de santé, tels que la maladie d'Alzheimer, l'arthrite, l'athérosclérose, l'hypertension, les maladies cardiaques, l'ostéoporose ou un accident vasculaire cérébral.
Santé des os
Des études scientifiques indiquent que l'acide orthosyllique stimule la production de collagène (protéine trouvée dans le tissu conjonctif) et dans la promotion du développement de cellules qui constituent des os.
Santé des cheveux
De même, des preuves scientifiques suggèrent que cet acide peut aider à améliorer la qualité et la santé des cheveux. Cet acide peut augmenter la force des cheveux et de l'épaisseur. En général, la qualité des cheveux s'améliore avec les suppléments d'acide orthosalicylique.
Les références
- Centre national d'information sur la biotechnologie. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Graham, t. (1863). Sur les propriétés de l'acide silicique et d'autres substances colloïdales analogues. Actes de la Royal Society of London. Récupéré de jstor.org.
- Composé chimique d'acide silicique. Récupéré de Britannica.com.

