Structure d'acide galique, propriétés, obtention, utilisations
- 4033
- 1288
- Jade Duval
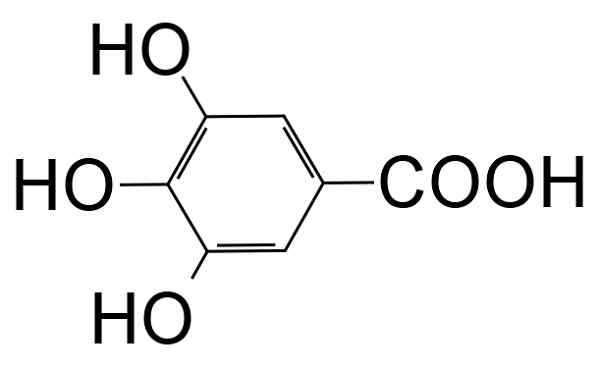
Il Acide gallique C'est un composé de formule moléculaire organique C6H2(OH)3COOH qui appartient à la catégorie des polyphénols. Il est reconnu car il a une forme de poussière cristalline près du jaune pâle.
Il s'agit d'un acide trihydroxybenzoïque qui est formé par un anneau de benzène auxquels un acide carboxylique (-coh) et 3 groupes hydroxyle (-OH) situés en positions 3, 4 et 5 de l'anneau sont unis unis.
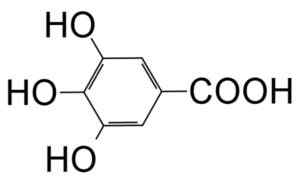 Structure moléculaire de l'acide gallique (acide 3,4,5-trihydroxibenzoïque). Vchorozopoulos [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons
Structure moléculaire de l'acide gallique (acide 3,4,5-trihydroxibenzoïque). Vchorozopoulos [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikipedia Commons De nature, il est largement diffusé, car c'est un produit qui est formé en quantités importantes dans les plantes et les champignons. Il y a des tanins libres ou attachés aux tanins de la plupart.
 écorce de chêne. Rob Mitchell [CC0]. Source: Wikipedia Commons
écorce de chêne. Rob Mitchell [CC0]. Source: Wikipedia Commons Il se trouve également dans le miel, le cacao, diverses baies, la mangue et autres fruits et légumes, et dans certaines boissons telles que les perfusions de vin et de thé.
Dans les tissus végétaux, il est sous forme d'ester ou de gallate. La quantité dans laquelle il est dépend de stimuli externes, comme la quantité de rayonnement UV que la plante, le stress chimique et les infections microbiennes ont reçues.
Dans le cas des raisins et du vin, cela dépend du raisin, du traitement et du stockage. Dans le thé vert, la teneur en galate est élevée, mais le cacao contient plus que le thé vert et le vin rouge.
Se comporte chimiquement comme un agent réducteur. Est astringent et antioxydant. Il a également été utilisé dans les encres bleues pour écrire et est couramment utilisé dans l'industrie pharmaceutique.
Il a un large potentiel dans les applications médicales, car les multiples propriétés de l'acide gallique et de ses dérivés en font un agent thérapeutique prometteur en médecine préventive.
[TOC]
Structure
L'acide galique cristallise dans le méthanol ou le chloroforme absolu sous forme d'aiguilles blanches. Cristallise dans l'eau en forme d'eau de votre monohydrate.
Nomenclature
- Acide gallique.
- Acide 3,4,5-trihydroxibenzoic.
Propriétés
État physique
Aiguilles solides et cristallines.
Poids moléculaire
170,12 g / mol.
Point de fusion
Il se décompose à 235-240 ºC, générant du pyrogalol et du CO2
Densité
1 694 g / cm3
Solubilité
Dans l'eau: modérément soluble.
- 1 g sur 87 ml d'eau
- 1 g dans 3 ml d'eau bouillante
Il peut vous servir: Chlorure de mercure (ii): structure, propriétés, obtention, utilisationsEn éthanol: 1 g dans 6 ml d'alcool.
Dans Dietyl Ether: 1 g sur 100 ml d'éther.
En glycérol: 1 g sur 10 ml de glycérol.
En acétone: 1 g dans 5 ml d'acétone.
Pratiquement insoluble dans le benzène, le chloroforme et l'éther d'huile.
Constante de dissociation
K1 4,63 x 10-3 (à 30 ºC).
K2 1,41 x 10-9
Propriétés chimiques
Les solutions d'acide galique, en particulier les sels métalliques alcalins, absorbent l'oxygène et deviennent bruns lorsqu'ils sont exposés à l'air.
L'acide galique est un agent réducteur fort qui peut réduire les sels d'or ou d'argent en métal. Il est incompatible avec les chloges, le permanganate, l'ammoniac, l'acétate de plomb, les hydroxydes alcalins, les carbonates alcalins, les sels d'argent et les agents oxydants en général.
Avec des sels de fer (II), l'acide gallique forme un complexe bleu intense.
Dans l'acide gallique, le groupe hydroxyle (-OH) en position 4 est le plus réactif chimiquement.
Autres propriétés
Il doit vous protéger de la lumière car il le dégrade photochimiquement.
C'est un irritant local doux. L'inhalation de poussière peut affecter le nez et la gorge et le contact avec les yeux et la peau provoque une irritation.
Les études de toxicité chez la souris indiquent que l'ingéré jusqu'à un niveau de 5000 mg / kg, l'acide gallique n'est pas toxique pour ces animaux. Il est considéré comme une faible toxicité et confirme la sécurité de son utilisation.
Obtention
L'acide galique est obtenu par hydrolyse alcaline ou acide de tanins de noix ou de matériaux végétaux riches en ces composés.
L'hydrolyse peut également être réalisée de manière enzymatique à l'aide de bouillons de culture de moisissure tels que Pénicillium glaucum ou la Aspergillus Niger, qui contiennent du tanasa, une enzyme qui brise ou divise la molécule de tanin.
Une autre façon d'obtenir l'acide gallique provient de l'acide p -hydroxibenzoïque, par sulfonation et fusion alcaline, ce qui atteint l'ajout des deux autres groupes -OH dans la molécule.
Applications
- Dans les encres et les colorants
L'acide galique est utilisé dans la fabrication d'antragalol et de pyrogalol qui sont des intermédiaires dans la production de colorants, comme la galocyanine et la galoflavine. À son tour, il s'agit de matières premières dans la synthèse des dérivés d'oxazine, qui sont également utilisés comme colorants.
Parce qu'il forme un complexe bleu avec du fer, l'acide gallique est très important dans la production d'encres pour écrire. Ces encres contiennent principalement un mélange d'acide gallique, sulfate ferreux (feso4) et le caoutchouc arabe.
Peut vous servir: acide de café: structure, propriétés, biosynthèse, utilisationsLes encres à l'acide fer galique ont été des documents indispensables pour la rédaction de documents, le dessin de plans et la préparation de documents écrits.
 Stylo à encre bleu. ButterflyLunch [domaine public]. Source: Wikipedia Commons
Stylo à encre bleu. ButterflyLunch [domaine public]. Source: Wikipedia Commons - Dans les applications médicales
Il est utilisé comme astringent intestinal et agent pour arrêter les hémorragies (stiptique). L'acide galique est une matière première pour obtenir le Ruffalol, qui est un agent antipalumique.
En raison de sa réduction chimique, l'acide gallique est utilisé dans la fabrication de produits pharmaceutiques.
- Dans les applications médicales potentielles
Contre le cancer
L'acide galique a été identifié comme principal responsable des propriétés anti-canancer de plusieurs extraits de plantes.
Contrairement à son action antioxydante particulière, il a été constaté qu'il peut présenter des caractéristiques pro-oxydantes dans l'induction de l'apoptose des cellules cancéreuses. L'apoptose est la destruction ordonnée des cellules endommagées causées par le même organisme.
 Une apoptose cellulaire. Ltunovskaya V. Nagibin [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons
Une apoptose cellulaire. Ltunovskaya V. Nagibin [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons Il existe des preuves que l'acide gallique et les galas induisent une apoptose sélective dans les cellules de croissance rapide, laissant des cellules saines intactes. Il a également été signalé que les freins d'angiogenèse, et par conséquent, l'invasion du cancer et des métastases.
Une activité anticancéreuse de l'acide gallique a été trouvée dans la leucémie, le cancer de la prostate, le poumon, l'estomac, le pancréas et le côlon, le cancer du sein, le cervical et l'œsophage.
Contre diverses pathologies
Dans plusieurs études, il a été démontré qu'il a des antifongiques, antibactériens, antiviraux, antiallergiques, anti-inflammatoires, anti-activités anti-ouverts, anti-gouvernementaux, anti-obésité et immunomodulatoires.
L'acide galique est un bon candidat pour contrôler la maladie parodontale (maladie des gencives).
Il présente également un potentiel neuroprotecteur, un cardioprotecteur, un hépatoprotecteur et un néphroprotecteur. Par exemple, dans diverses études sur les tissus cardiaques chez le rat, il a été confirmé que l'acide gallique exerce un effet protecteur du myocarde contre le stress oxydatif.
En tant qu'agent anti-âge cellulaire
L'acide galique offre une protection efficace contre les dommages oxydatifs causés par les espèces réactives trouvées dans les systèmes biologiques, tels que les radicaux hydroxyles (OH.), superoxyde (ou2.) et le peroxyle (ROO.).
Il a été déterminé que dans le tube digestif, il est absorbé plus rapidement que la plupart des polyphénols. Et est l'un de ceux qui ont la plus grande capacité antioxydante.
Peut vous servir: enthalpieDe plus, certains chercheurs affirment que l'acide gallique peut être transporté par les enfants pour augmenter son activité anti-âge. Le niosoma est un système moléculaire de liborations de médicaments contrôlés à la place de l'organisme qui l'exige.
Ces caractéristiques lui donnent un potentiel élevé contre le vieillissement des cellules.
- Dans les utilisations vétérinaires
Il a été utilisé comme animal chez les animaux.
- Dans diverses applications
L'acide galique est utilisé dans la fabrication de ses esters, tels que la gallate de méthyle, la gallate de propyle, le gallate d'octilo et le gallate de laurilo.
Ces dérivés sont largement utilisés comme antioxydants et conservateurs d'aliments transformés, dans les matériaux alimentaires, pour prévenir l'élan oxydatif et la détérioration. Les dérivés mentionnés sont également utilisés dans les cosmétiques.
L'acide galique est utilisé comme développeur photographique et dans la fabrication de papier. De plus, il est largement utilisé dans la stabilisation du collagène dans le processus de bronzage en cuir.
En tant que réactif analytique, l'acide gallique est idéal comme standard pour déterminer la teneur en phénolique des extraits de plantes, et les résultats sont exprimés en équivalents de l'acide gallique.
Il est également utilisé dans les tests pour déterminer les acides minéraux libres, la dihydroxyacétone et les alcaloïdes.
- Utilité dans des environnements aquatiques naturels
L'acide galique, naturellement présent dans les aquifères en matière végétale, est l'un des responsables de la disponibilité des nutriments de la foi (ii) nécessaire à la croissance des espèces aquatiques.
En effet, il est capable de maintenir des niveaux élevés de concentration en fer (II) dissous dans des conditions aérobies. C'est parce qu'il forme un complexe avec la foi (ii) résistant à l'oxydation.
 Espèce aquatique: truite. John Image française. Source: Pixabay
Espèce aquatique: truite. John Image française. Source: Pixabay Les références
- Saxide, m. et al. (2019). Livraison en nanoparticules de phytomédicines: défis et opportunités. Dans un nouveau look sur la phytomédicine. Chapitre 23. Récupéré de ScienceDirect.com.
- Windholz, M.; Budavari, s.; Blumetti, R. F. et Otterbein, et. (éditeurs) (1983). L'indice Merck. Dixième édition. Merck & Co., Inc.
- CRC Handbook of Chemistry and Physics. 75e 1994. CRC Press, Inc.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume A13. VCH VERLAGSGELLSCHAFT MBH.
- Badhani, B; Sharma, n. et Kakkar, R. (2015). Acide gallique: un antioxydant polyvalent avec des applications thérapeutiques et industrielles prometteuses. Avances RSC. RSC a récupéré.org.
- Zanwar, Anand A., et al. (2014). Rôle de l'acide gallique dans les troubles cardiovasculaires. Dans les polyphénols en santé humaine et maladie. Chapitre 80. Récupéré de ScienceDirect.com.
- Nowak, R. et al. (2014). Planter les polyphénols en tant qu'agents chimiopréventifs. Dans les polyphénols en santé humaine et maladie. Chapitre 97. Récupéré de ScienceDirect.com.
- « Bataille de la bataille d'Angleterre, développement, conséquences
- Structure d'acide sulfanilique, propriétés, synthèse, utilisations »

