Structure du trioxyde de soufre (SO3), propriétés, risques, utilisations
- 3856
- 186
- Paul Dumas
Il Trioxyde de soufre Il s'agit d'un composé inorganique formé par l'union d'un atome de soufre et de 3 atomes d'oxygène (O). Sa formule moléculaire est ainsi3. À température ambiante, le SO3 C'est un liquide qui dégage des gaz dans l'air.
La structure du SO3 Gazeux est plat et symétrique. Les trois oxygène sont situés équitablement autour du soufre. So3 Réagit violemment avec l'eau. La réaction est exothermique, ce qui signifie que la chaleur est produite, en d'autres termes, beaucoup est chauffé.
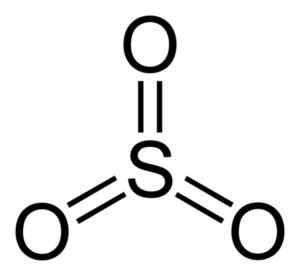 Molécule de trioxyde de soufre donc3. Auteur: Benjah-bmm27. Source: Wikimedia Commons.
Molécule de trioxyde de soufre donc3. Auteur: Benjah-bmm27. Source: Wikimedia Commons. Quand le SO3 Le liquide refroidit, il devient un solide qui peut avoir trois types de structure: alpha, bêta et gamma. Le plus stable est l'alpha, sous forme de couches avec l'autre constituant un réseau.
Le trioxyde de soufre gazeux est utilisé pour préparer l'acide sulfurique fumer, également appelé huile, en raison de sa ressemblance d'huile ou de substance huileuse. Une autre de ses applications importantes réside dans la sulfonation des composés organiques, c'est-à-dire l'ajout de groupes -SO3- à ceux-là. Ainsi, des produits chimiques utiles peuvent être préparés comme des détergents, des colorants, des pesticides, entre autres.
So3 C'est très dangereux, cela peut provoquer de graves brûlures, des yeux et des dommages cutanés. Il ne doit pas non plus être inhalé ou ingéré car il peut provoquer la mort par des brûlures internes, dans la bouche, l'œsophage, l'estomac, etc.
Pour ces raisons, il doit être manipulé avec une grande prudence. Vous ne devez jamais contacter l'eau ou les matériaux combustibles tels que le bois, le papier, les tissus, etc., Eh bien, le feu peut être produit. Il ne doit pas non plus être jeté ou égouttement en raison du danger d'explosion.
So3 Le gazeux généré dans les processus industriels ne doit pas être libéré dans l'environnement, car il s'agit de l'une des responsables des pluies acides qui ont déjà endommagé de grandes extensions de forêts dans le monde.
[TOC]
Structure
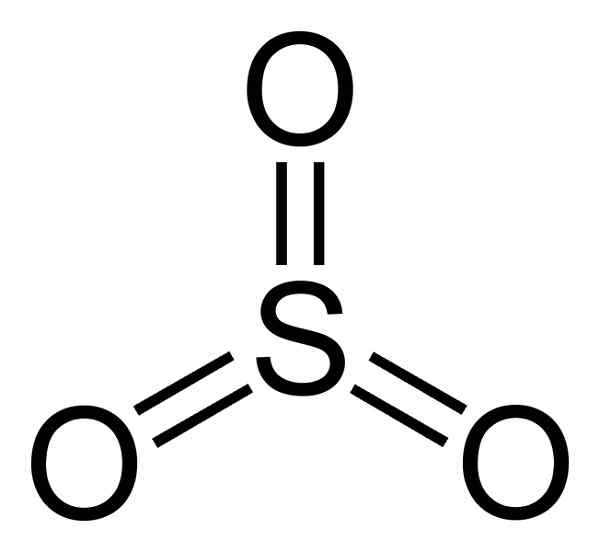
La molécule de trioxyde de soufre donc3 À l'état gazeux, il a une structure triangulaire plate.
Cela signifie que le soufre et trois oxygène se trouvent dans le même plan. De plus, la distribution de l'oxygène et de tous les électrons est symétrique.
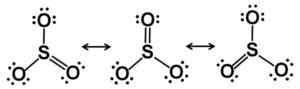 Starcutures de résonance de Lewis. Les électrons sont équitablement distribués dans le SO3. Auteur: Marilú Stea.
Starcutures de résonance de Lewis. Les électrons sont équitablement distribués dans le SO3. Auteur: Marilú Stea. À l'état solide, trois types de structure SO sont connus3: Alfa (α-SO3), bêta (β-so3) et gamma (γ-so3).
La forme gamma γ-so3 contient des coupe-cycliques, c'est-à-dire trois unités de SO3 Ensemble de la formation d'une molécule cyclique ou en forme de cycle.
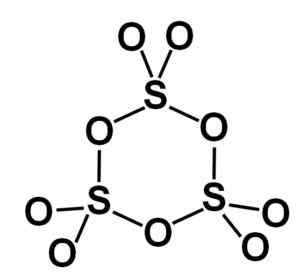 Molécule annulaire du type de trioxyde de soufre solide gamma. Auteur: Marilú Stea.
Molécule annulaire du type de trioxyde de soufre solide gamma. Auteur: Marilú Stea. La phase bêta β-so3 Il a des chaînes hélicoïdales infinies de tétraède de composition donc4 uni les uns avec les autres.
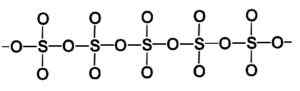 Structure d'un type de trioxyde de soufre solide bêta. Auteur: Marilú Stea.
Structure d'un type de trioxyde de soufre solide bêta. Auteur: Marilú Stea. Le moyen le plus stable est Alpha α-SO3, Similaire à la version bêta mais avec une structure de couche, les chaînes unies formant un réseau.
Nomenclature
-Trioxyde de soufre
-Anhydride sulfurique
-Oxyde sulfurique
-Swin3 Gamma, γ-so3
-Swin3 bêta, β-so3
-Swin3 Alfa, α-SO3
Propriétés physiques
État physique
À température ambiante (environ 25 ºC) et la pression atmosphérique, le SO3 C'est un liquide incolore qui émet des fumées dans l'air.
Quand le SO3 Le liquide est pur à 25 ºC est un mélange de SO3 monomère (une seule molécule) et trimérique (3 molécules liées) de formule S3SOIT9, Aussi appelé SO3 Gamma γ-so3.
Peut vous servir: Scale de Rankine: ce qui est, les conversions, les exemplesLors de la baisse de la température, si le SO3 Il est pur lorsqu'il atteint 16,86 ºC, il se solidifie ou gèle γ-SO3, Aussi appelé "So Ice3".
S'il contient de petites quantités d'humidité (même des traces ou des quantités extrêmement petites) le SO3 Polymérise la bêta β-s3 qui forme des cristaux avec une luminosité soyeuse.
Ensuite, plus de syndicats sont formés en générant la structure α-SO3, qui est un solide cristallin sous forme d'aiguilles qui ressemblent à l'amiante ou à l'amiante.
Lorsque l'alpha et la fonte des bêta génèrent du gamma.
Poids moléculaire
80,07 g / mol
Point de fusion
Swin3 Gamma = 16,86 ºC
Point triple
C'est la température à laquelle les trois états physiques sont présents: solide, liquide et gazeux. Sous la forme alpha, le point triple est à 62,2 ºC et en bêta, il est à 32,5 ºC.
En chauffant la forme alpha, cela a une plus grande tendance à sublimer que à fondre. Sublimimar signifie passer directement de l'état solide vers le soda, sans passer par l'état liquide.
Point d'ébullition
Toutes les formes de SO3 bouillir à 44,8 ºC.
Densité
So3 Le liquide (gamma) a une densité de 1 9225 g / cm3 à 20 ºC.
So3 Gaseous a une densité de 2,76 par rapport à l'air (air = 1), indiquant qu'il est plus lourd que l'air.
La pression de vapeur
Swin3 Alfa = 73 mm Hg à 25 ºC
Swin3 Beta = 344 mm Hg à 25 ° C
Swin3 Gamma = 433 mm Hg à 25 ºC
Cela signifie que la forme gamma a tendance à s'évaporer plus facilement que la version bêta et cela que l'alpha.
La stabilité
La forme alpha est la structure la plus stable, les autres sont métastables, c'est-à-dire qu'ils sont moins stables.
Propriétés chimiques
So3 réagit énergiquement avec l'eau pour donner de l'acide sulfurique H2Swin4. Lorsque vous réagissez, il y a très de chaleur pour que la vapeur d'eau soit rapidement détachée du mélange.
Être exposé à l'air le so3 absorber rapidement l'humidité, émettant des vapeurs denses.
C'est un agent déshydratant très fort, cela signifie qu'il élimine facilement l'eau des autres matériaux.
Le soufre du SO3 Il a une affinité pour les électrons libres (c'est-à-dire des électrons qui ne sont pas dans un lien entre deux atomes), il a donc tendance à former des complexes avec des composés qui les possèdent comme la pyridine, la triméthylamine ou le dioxane.
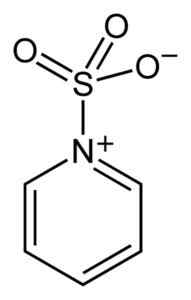 Complexe entre le trioxyde de soufre et la pyridine. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Complexe entre le trioxyde de soufre et la pyridine. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. En formant des complexes, le soufre prend «emprunté» les électrons de l'autre composé pour satisfaire leur absence. Le trioxyde de soufre est toujours disponible dans ces complexes, qui sont utilisés dans les réactions chimiques pour fournir ainsi3.
Il s'agit d'un puissant réactif sulfonant des composés organiques, ce qui signifie qu'il sert à ajouter facilement un groupe -SO3- Aux molécules.
Il réagit facilement avec les oxydes de nombreux métaux pour donner des sulfates de ces métaux.
Il est corrosif envers les métaux, les tissus animaux et végétaux.
So3 C'est un matériau difficile à gérer pour plusieurs raisons: (1) son point d'ébullition est relativement faible, (2) a tendance à former des polymères solides à des températures inférieures à 30 ºC et (3) a une réactivité élevée envers presque toutes les substances organiques Et l'eau.
Peut vous servir: solides amorphes: structure, propriétés, exemplesIl peut polymériser de manière explosive s'il ne contient pas de stabilisateur et il y a une présence d'humidité. Comme les stabilisateurs, le diméthylsulfate ou l'oxyde de bore sont utilisés.
Obtention
Il est obtenu par la réaction à 400 ºC entre le dioxyde de soufre2 et oxygène moléculaire ou2. Cependant, la réaction est très lente et les catalyseurs sont nécessaires pour augmenter la vitesse de ce.
2 Alors2 + SOIT2 ⇔ 2 SO3
Parmi les composés qui accélèrent cette réaction figurent le Pt Pt-Metal Pt, le vanadium pentoxyde V2SOIT5, Oxyde ferrique2SOIT3 et oxyde nitrique.
Applications
En préparation de pétrole
L'une de ses principales applications consiste à préparer l'huile ou l'acide sulfurique de l'huile ou de la fumée, appelée car elle émet des vapeurs visibles à l'œil nu. Pour l'obtenir, le SO est absorbé3 Dans l'acide sulfurique concentré H2Swin4.
 PU-sulfurique oléum ou tabagisme. Vous pouvez voir la fumée blanche sortir de la bouteille. W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
PU-sulfurique oléum ou tabagisme. Vous pouvez voir la fumée blanche sortir de la bouteille. W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Cela se fait dans des tours spéciales en acier inoxydable où de l'acide sulfurique concentré (qui est liquide)3 Gaseous monte.
Le liquide et le gaz entrent en contact et rejoignent, formant l'oléum qui est un apparence grasse liquide. Cela a un mélange de h2Swin4 Et ainsi3, mais il possède également des molécules d'acide disulfurique H2S2SOIT7 et trisulfuric h2S3SOITdix.
Dans les réactions de sulfonation chimique
La sulfonation est un processus clé dans les applications industrielles à grande échelle pour la fabrication de détergents, de surfactants, de colorants, de pesticides et de produits pharmaceutiques.
So3 Il sert d'agent sulfonant pour préparer des huiles sulfonées et des détergents alkyl-angal-sulfonés, entre autres composés. Vous trouverez ci-dessous la réaction de sulfonation d'un composé aromatique:
Arh + donc3 → ARSO3H
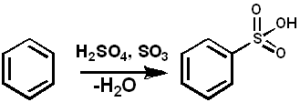 Sulfonation de la benzène avec SO3. Pedro8410 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Sulfonation de la benzène avec SO3. Pedro8410 [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Pour les réactions de sulfonation, l'oléum peut être utilisé3 sous la forme de ses complexes avec de la pyridine ou de la triméthylamine, entre autres.
Dans l'extraction des métaux
Gaz3 Il a été utilisé dans le traitement des minéraux. Les oxydes métalliques simples peuvent devenir des sulfates beaucoup plus solubles lorsqu'ils les traitent avec SO3 à des températures relativement basses.
Les minéraux de soufre tels que la pyrite (sulfure de fer), les voies3 Permet à ces métaux facilement et à faible coût.
Le fer, le nickel et les sulfures de cuivre réagissent avec SO GAS3 Même à température ambiante, formant les sulfates respectifs, qui sont très solubles et peuvent être soumis à d'autres processus pour obtenir du métal pur.
Dans plusieurs utilisations
So3 Il sert à préparer l'acide chlorosulfurique également appelé acide chlorosulfonique HSO3CL.
Le trioxyde de soufre est un oxydant très puissant et est utilisé dans la fabrication explosive.
Des risques
Pour la santé
So3 C'est un composé hautement toxique par toutes les routes, c'est-à-dire l'inhalation, l'ingestion et le contact cutané.
Irrita et corrode les muqueuses. Provoque la peau et les yeux. Ses vapeurs sont très toxiques lorsqu'ils sont inhalés. Des brûlures internes sont produites, des difficultés respiratoires, des douleurs thoraciques et un œdème pulmonaire.
Peut vous servir: butanone: structure, propriétés et utilisations Le trioxyde de soufre SO3 est très corrosif et dangereux. Auteur: Openicons. Source: Pixabay.
Le trioxyde de soufre SO3 est très corrosif et dangereux. Auteur: Openicons. Source: Pixabay. C'est toxique. Son ingestion génère une brûlure grave, l'œsophage et l'estomac. De plus, on soupçonne qu'il est cancérigène.
Feu ou explosion
Il représente le danger des incendies lorsqu'il entre en contact avec des matériaux biologiques tels que le bois, les fibres, le papier, l'huile, le coton, entre autres, surtout s'ils sont humides.
Il y a aussi un risque si vous entrez en contact avec des bases ou des agents réducteurs. Il est combiné avec de l'eau de manière explosive, formant de l'acide sulfurique.
Le contact avec les métaux peut produire de l'hydrogène gaz2 ce qui est très inflammable.
Il doit être évité dans les vaisseaux en verre pour éviter une éventuelle rupture violente du récipient.
Impact environnemental
So3 Il est considéré comme l'un des plus grands polluants présents dans l'atmosphère terrestre. Cela est dû à son rôle dans la formation d'aérosols et sa contribution aux pluies acides (en raison de la formation d'acide sulfurique H2Swin4).
 Forêt endommagée par des pluies acides en République tchèque. Lovecz [domaine public]. Source: Wikimedia Commons.
Forêt endommagée par des pluies acides en République tchèque. Lovecz [domaine public]. Source: Wikimedia Commons. So3 Il se forme dans l'atmosphère en raison de l'oxydation du dioxyde de soufre2. Quand le SO est formé3 Cela réagit rapidement avec l'eau pour former l'acide sulfurique h2Swin4. Selon des études récentes, il existe d'autres mécanismes de transformation SOS3 Dans l'atmosphère, mais en raison de la grande quantité d'eau présente dans celui-ci, le SO est toujours considéré3 Principalement converti en h2Swin4.
So3 Gas ou déchets gazeux industriels qui les contient ne doivent pas être téléchargés dans l'atmosphère car c'est un contaminant dangereux. C'est un gaz extrêmement réactif et, comme cela a déjà été dit ci-dessus, en présence d'humidité de l'air le SO3 Il devient l'acide sulfurique h2Swin4. Par conséquent, dans l'air le SO3 persiste sous forme d'acide sulfurique formant de petites gouttelettes ou des aérosols.
Si les gouttelettes d'acide sulfurique pénètrent dans les voies respiratoires de l'humain ou des animaux, ils se développent rapidement à cause de l'humidité présente, ils ont donc la possibilité de pénétrer les poumons. L'un des mécanismes par le brouillard acide de H2Swin4 (il en est ainsi3) Il peut produire une forte toxicité parce que le pH extracellulaire et intracellulaire des organismes vivants (plantes, animaux et être humain) change).
Selon certains chercheurs, alors brouillard3 C'est la cause de l'augmentation des asthmatiques dans une région du Japon. Le brouillard de SO3 Il a un effet très corrosif sur les métaux, de sorte que les structures métalliques construites par l'être humain telles que certains ponts et constructions peuvent être très affectées.
So3 Le liquide ne doit pas être jeté dans le drainage des eaux sales ou des égouts. S'il est versé dans les égouts, vous pouvez créer un danger de feu ou d'explosion. S'il est renversé par accident, un flux d'eau ne doit pas être dirigé vers le produit. Il ne doit jamais être absorbé par la sciure ou un autre carburant absorbant, car il peut générer des incendies.
Il doit être absorbé dans le sable sec, la terre sèche ou d'autres absorbants inertes totalement secs. So3 Il ne doit pas être versé dans l'environnement et ne devrait jamais entrer en contact avec cela. Il doit être maintenu loin des sources d'eau car cela produit de l'acide sulfurique qui est nocif pour les organismes aquatiques et terrestres.
Les références
- Sarkar, s. et al. (2019). Influence de l'ammoniac et de l'eau sur le sort du trioxyde de soufre dans la troposphère: recherche théorique de l'acide sulfamique et des voies de formation d'acide sulfurique. J Phys Chem A.2019; 123 (14): 3131-3141. NCBI a récupéré.NLM.NIH.Gouvernement.
- Muller, t.L. (2006). Trioxyde d'acide sulfurique et de soufre. Encyclopédie Kirk-othmer de la technologie chimique. Volume 23. Récupéré de la bibliothèque en ligne.Wiley.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Trioxyde de soufre. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Kikuchi, R. (2001). Gestion environnementale de l'immission du trioxyde de soufre: impact de SO3 Sur la santé humaine. Gestion de l'environnement (2001) 27: 837. Lien récupéré.Springer.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Ismail, m.Toi. (1979). Extraction des métaux à partir de sulfures à l'aide de trioxyde de soufre dans un lit fluidisé. J. Chem. Technologie. Biotechnol. 1979, 29, 361-366. Récupéré de la bibliothèque en ligne.Wiley.com.
- « Malawi Lago Géographie, géologie, importance, faune, Rios
- Structure du cyanure de sodium (NACN), propriétés, risques, utilisations »

