Pièces de cellules galvaniques, comment fonctionne, applications, exemples
- 1717
- 243
- Louna Baron
La Pile galvanique o La cellule voltaïque est un type de cellule électrochimique qui se compose de deux métaux différents immergés dans deux semi-lades, dans lesquelles un composé en solution active est une réaction spontanée.
Ensuite, l'un des métaux de l'une des semi-llades est oxydé tandis que le métal de l'autre semi-média est réduit, produisant un échange d'électrons à travers un circuit externe. Cela permet de profiter du courant électrique.
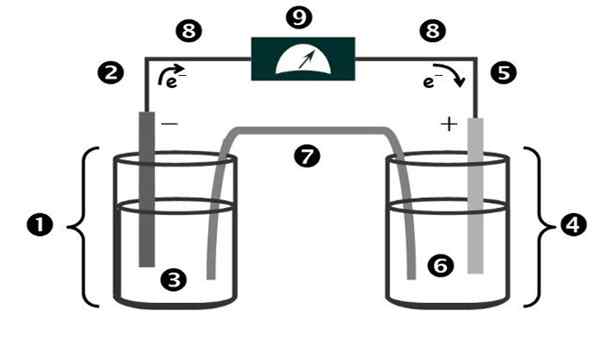
 Figure 1. Schéma et parties d'une cellule galvanique. Source: Corinthe.PUCP.Édu.pe.
Figure 1. Schéma et parties d'une cellule galvanique. Source: Corinthe.PUCP.Édu.pe. Le nom de la "cellule galvanique" est en l'honneur de l'un des pionniers de l'expérimentation avec l'électricité: le médecin et physiologiste italien Luigi Galvani (1737-1798).
Galvani a découvert en 1780 que s'ils se joignaient à une extrémité des câbles de différents métaux et que les extrémités libres étaient mises en contact avec l'ANCA d'une grenouille (mort), puis une contraction s'est produite.
Cependant, le premier à construire une cellule électrochimique pour produire de l'électricité était également l'italien Alessandro Volta (1745-1827) en 1800 et donc le nom alternatif de la cellule voltaïque.
Parties de la cellule galvanique
Les parties d'une cellule galvanique sont illustrées à la figure 1 et sont les suivantes:
1.- Semi-média anodique
2.- Électrode d'anodium
3.- Solution anodique
4.- Semi-média cathodique
5.- Électrode cathodique
6.- Solution cathodique
7.- Pont saline
8.- Chef d'orchestre métallique
9.- Voltmètre
Fonctionnement
Pour expliquer le fonctionnement d'une cellule galvanique, nous compterons sur le plus bas:
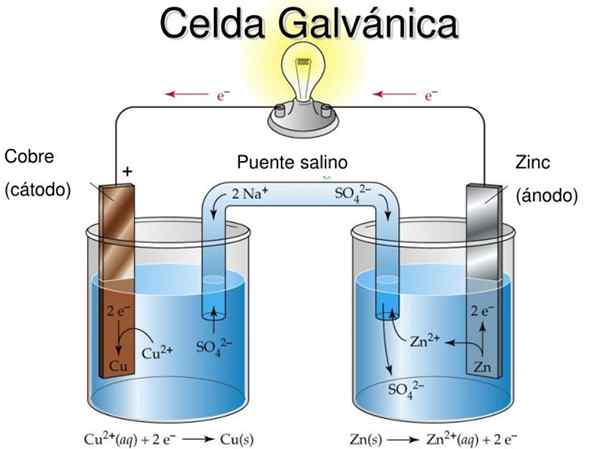 Figure 2. Modèle didactique de cellules galvaniques. Source: Slideserve.com
Figure 2. Modèle didactique de cellules galvaniques. Source: Slideserve.com L'idée fondamentale d'une cellule galvanique est que le métal subis par la réaction d'oxydation est physiquement séparé du métal réduit, de sorte que l'échange d'électrons se produit à travers un conducteur externe qui permet de profiter du flux de courant électrique , Par exemple pour allumer une ampoule ou une LED.
Dans la figure 2 dans la semi-média à gauche, vous avez un ruban de cuivre métallique (Cu) immergé dans une solution de sulfate de cuivre (CUS04), Tandis que dans le semi-lid droit, il y a un ruban de zinc (Zn) immergé dans une solution de sulfate de zinc (ZNSO4).
Il convient de noter que dans chaque semi-média, le métal de chacun est présent dans deux états d'oxydation: les atomes de métal neutre et les ions métalliques du sel du même métal en solution.
Si les bandes métalliques ne sont pas liées par un câble conducteur extérieur, les deux métaux s'oxydent séparément dans leurs cellules respectives.
Cependant, lorsqu'il sera connecté électriquement, l'oxydation se produira dans le Zn alors qu'il y aura une réaction de réduction de Cu. En effet, le degré d'oxydation du zinc est supérieur à celui du cuivre.
Le métal qui oxyde donne le métal réduit à travers le conducteur extérieur et ce flux de courant peut être utilisé.
Peut vous servir: dérivés halogénésRéactions d'oxydation et de réduction
La réaction qui se produit sur le côté droit entre l'électrode en métal de zinc et la solution aqueuse de sulfate de zinc est la suivante:
Znsoit(S) + Zn2+ (SW4)2- → 2 Zn2+(AC) + (SW4)2- + 2 e-
Un atome de zinc (solide) à la surface de l'électrode anodique en semi-le droit de la droite, stimulé par les ions positifs du zinc en solution, donne deux électrons et émerge de l'électrode, allant à la solution aqueuse En tant que double ion positif de zinc.
Nous avons réalisé que le résultat net était qu'un atome de zinc métallique neutre, en perte de deux électrons, est devenu un ion de zinc qui ajoute à la solution aqueuse, de sorte que la barre de zinc a perdu un atome et la solution a acquis un double ion positif.
Les électrons libérés préféreront se déplacer à travers le câble externe vers le métal de l'autre semi-média avec une charge positive (cartodo +). La barre de zinc perd la masse car ses atomes passent progressivement à la solution aqueuse.
L'oxydation du zinc peut être résumé comme suit:
Znsoit(S) → Zn2+(AC) + 2 e-
La réaction qui se produit sur le côté gauche est similaire, mais le cuivre de la solution aqueuse capture deux électrons (provenant de l'autre semi-thématique) et est déposé dans l'électrode de cuivre. Lorsqu'un atome capture des électrons, il est dit réduit.
La réaction de réduction du cuivre est écrite comme ceci:
Cu2+(AC) + 2 e- → Cusoit(S)
La barre de cuivre gagne de la pâte, car les ions de la solution passent à la barre.
L'oxydation se produit dans l'anode (négative), qui repousse les électrons, tandis que la réduction se produit en cathode (positif), qui attire les électrons. L'échange d'électrons se produit via le conducteur externe.
Le pont salin
Le pont salin équilibre les charges qui s'accumulent dans les deux semi-lies. Dans les ions positifs anodiques semi-diad.
Pour le pont salin, une solution d'un sel (comme du chlorure de sodium ou du chlorure de potassium) est utilisée qui n'intervient pas dans la réaction, qui se trouve dans un tube inversé en U avec ses extrémités branchées avec une paroi de matériau poreux.
Le seul but du pont salin est que les ions soient filtrés à chaque équilibrage cellulaire ou neutralisant la charge excessive. Ainsi, à travers le pont salin, il y a un flux de courant, à travers les ions salins, qui ferme le circuit électrique.
Potentiels d'oxydation et de réduction
Les potentiels d'oxydation et de réduction standard sont compris.
Il peut vous servir: Scandio: Historique, propriétés, réactions, risques et utilisationsPour le zinc, son potentiel d'oxydation standard estbœuf = +0,76 V. Pendant ce temps, le potentiel de réduction standard pour le cuivre est etgrille = +0,34 V. La force électromotive (FEM) produite par cette cellule galvanique est: FEM = +0,76 V + 0,34 V = 1,1 V.
La réaction globale de la cellule galvanique peut être écrite comme ceci:
Znsoit(S) + Cu2+(AC) → Zn2+(AC) + Cusoit(S)
Prendre en compte le sulfate La réaction nette est:
Znsoit(S) + Cu2+ (SW4)2- 25ºC → Zn2+ (SW4)2-+ Cusoit(S)
Le sulfate est un spectateur, tandis que les métaux échangent des électrons.
Représentation symbolique d'une cellule galvanique
La cellule galvanique de la figure 2 est symboliquement représentée comme suit:
Znsoit(S)| Zn2+(AC) (1m) || Cu2+(AC) (1m) | Cusoit(S)
Par convention, à gauche le métal qui oxyde et forme l'anode (-) et séparé par une barre (|) son ion à l'état aqueux est toujours placé. Le semi-médium anodique est séparé du cathodique par deux barres (||) qui représente le pont salin. À droite, le semi-médium métallique qui est réduit et forme la cathode (+).
Dans la représentation symbolique d'une cellule galvanique, la fin est toujours le métal qui s'oxyde et à la fin, le métal est placé (à l'état solide) qui est réduit. Il convient de noter que dans la figure 2, les Semincels sont en sens inverse en ce qui concerne la représentation symbolique conventionnelle.
Applications
Connu les potentiels d'oxydation standard de différents métaux, il est possible de déterminer la force électromotive qui produira un tas galvanique construit avec ces métaux.
Dans cette section, ce qui précède s'appliquera dans les sections précédentes pour calculer la force électromotrice nette d'une cellule construite avec d'autres métaux.
À titre d'exemple d'application, nous considérons une cellule de fer galvanique (foi) et du cuivre (Cu). À titre de données, les réactions de réduction suivantes et son potentiel de réduction standard sont donnés, c'est-à-dire à 25 ° C et 1M de concentration:
Foi2+(AC) + 2 e- → foi(S). E1grille = -0,44 V
Cu2+(AC) + 2 e- → Cu(S). E2grille = +0,34 V
Il est invité à trouver la force électromotrice nette produite par la cellule galvanique suivante:
Foi(S)| Foi2+(AC)(1m) || Cu2+(AC)| Cu(S)
Dans cette pile, le fer s'oxyde et est l'anode de la cellule galvanique, tandis que le cuivre est réduit et est la cathode. Le potentiel d'oxydation du fer est le même mais par opposition à son potentiel de réduction, c'est-à-dire E1Oxd = +0,44.
Pour obtenir la force électromotive produite par cette cellule galvanique, nous ajoutons le potentiel d'oxydation du fer avec le potentiel de réduction du cuivre:
Peut vous servir: oxydes d'azote (NOx)FEM = E1Oxd + E2grille = -E1grille + E2grille = 0,44 V + 0,34 V = 0,78 V.
Cellule galvanique dans la vie quotidienne
Les cellules galvaniques à usage quotidien sont loin de la forme utilisée comme modèle didactique, mais leur principe de fonctionnement est le même.
La cellule d'utilisation la plus courante est une batterie alcaline de 1,5 V dans ses différentes présentations. Le prénom vient parce qu'il s'agit d'un ensemble de cellules connectées en série afin d'augmenter le FEM.
Les batteries de lithium rechargeables sont également basées sur le même principe de fonctionnement des cellules galvaniques et sont celles utilisées dans les smartphones, les montres et autres appareils.
De la même manière, les batteries en plomb de voitures, de motos et de bateaux sont de 12 V et sont basées sur le même principe de fonctionnement de la cellule galvanique.
Les cellules galvaniques sont utilisées dans l'esthétique et la régénération musculaire. Il existe des traitements faciaux qui consistent à appliquer le courant par deux électrodes sous la forme d'un rouleau ou d'une sphère qui nettoient et tonifie la peau.
Les impulsions actuelles s'appliquent également à régénérer la musculature chez les personnes qui sont dans un état de prostration.
Construction d'une cellule galvanique maison
Il existe de nombreuses façons de construire une cellule galvanique maison. L'un des plus simples consiste à utiliser du vinaigre comme solution, des ongles en acier et des câbles en cuivre.
Matériaux
-Navires en plastique jetables
-Vinaigre blanc
-Deux vis en acier
-Deux morceaux de fil de cuivre nu (sans isolation ou vernis)
-Un voltmètre
Procédure
-Remplissez ¾ parties du verre de vinaigre.
-Rejoignez les deux vis en acier avec plusieurs tours de fil, en laissant un morceau de fil sans enrouler.
L'extrémité sans fin du câble en cuivre est pliée dans un inversé en U inversé.
 figure 3. Cellule et multimètre galvaniques maison. Source: YouTube.com
figure 3. Cellule et multimètre galvaniques maison. Source: YouTube.com Un autre morceau de câble de cuivre est également plié dans un inversé et est suspendu sur le bord du verre en position diamétralement opposée aux vis submergées, de sorte qu'une partie du cuivre est à l'intérieur du vinaigre et de l'autre partie du câble de cuivre à l'extérieur de l'extérieur de l'extérieur de le verre.
Les extrémités libres des câbles de voltmètre sont connectées pour mesurer la force électromotive produite par cette cellule simple. La FEM de ce type de cellule est de 0,5 V. Pour correspondre au FEM d'une batterie alcaline, il est nécessaire de construire deux autres cellules et de rejoindre les trois en série, de sorte qu'une batterie de 1,5 V est obtenue
Les références
- Bornéo, R. Cellules galvaniques et électrolytiques. Récupéré de: Classes Quimica.Blogspot.com
- Cedrón, J. Chimie générale. PUCP. Récupéré de: Corinthe.PUCP.Édu.pe
- Farrera, L. Introduction à l'électrochimie. Département de physicochimie de l'UNAM. Récupéré de: DEPA.Finesse.Unam.mx.
- Wikipédia. Cellule électrochimique. Récupéré de: est.Wikipédia.com.
- Wikipédia. Pile galvanique. Récupéré de: est.Wikipédia.com.

