Caractéristiques de la catalase, structure, fonctions, pathologies
- 2734
- 430
- Prof Noah Collet
La catalase Il s'agit d'une enzyme oxydoréductase (H2O2: H2O2 oxydorreductase) largement distribuée dans la nature. Catalyse, dans divers tissus et types de cellules, la réaction de «décomposition» du peroxyde d'hydrogène dans l'oxygène moléculaire et l'eau.
Les premières observations de ce type d'enzyme remontent au début des années 1810, mais c'est en 1901 lorsque Loew a reconnu que la catalase est pratiquement présente dans tous les organismes vivants existants et dans plusieurs types de cellules différentes.
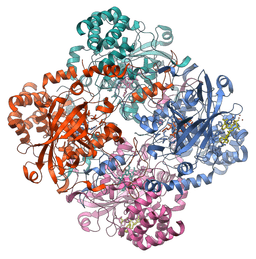
 Structure moléculaire de l'enzyme catalase (Source: Vossman [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] via Wikimedia Commons)
Structure moléculaire de l'enzyme catalase (Source: Vossman [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] via Wikimedia Commons) Cette enzyme, cruciale pour le maintien de l'intégrité cellulaire et le principal régulateur du métabolisme du peroxyde d'hydrogène, était un facteur fondamental pour affirmer que dans la nature, il existe des enzymes qui agissent sur des substrats spécifiques.
Les mammifères et autres organismes ont des enzymes catalas qui peuvent également se comporter comme des peroxydases, catalysant les réactions oxydantes de différents substrats à l'aide de peroxyde d'hydrogène.
Dans la plupart des eucaryotes, les enzymes catalas sont prépondérantes dans les organites subcellulaires appelés «peroxysomes», et chez l'homme, il existe de nombreuses conditions pathologiques liées à la carence en cette enzyme.
[TOC]
Caractéristiques
L'activité des enzymes telles que la catalase peut varier considérablement en fonction du type de tissu considéré. Chez les mammifères, par exemple, l'activité de la catalase est significative à la fois dans les reins et dans le foie, et est beaucoup plus faible dans les tissus conjonctifs.
De sorte que la catalase chez les mammifères est principalement associée à tous les tissus qui ont un métabolisme aérobie important.
Les mammifères ont des catalas à la fois dans les mitochondries et dans les peroxysomes et dans les deux compartiments sont des enzymes associées aux membranes organe. Dans les érythrocytes, au contraire, l'activité catalase est associée à une enzyme soluble (rappelez-vous que les érythrocytes ont des organites internes rares).
Peut vous servir: à moitié Stuart: fondation, préparation et utilisationsLa catalase est une enzyme avec un nombre élevé de remplacement ou de catalytique constante (il est très rapide et efficace) et la réaction générale qui catalyse est la suivante:
2H2O2 → 2H2O + O2
En présence de faibles concentrations de peroxyde d'hydrogène, la catalase mammifère, par exemple, se comporte comme une oxydase, utilisant l'oxygène moléculaire (O2) pour oxyder les molécules telles que l'indole et la β-pényléthylamine, les précurseurs de l'acide aminé du tryptophane et un neurotransmetteur, respectivement.
Certains inhibiteurs concurrentiels de l'activité de la catalase sont actuellement connus et parmi eux se distinguent par le sodium et le 3-amynotriazole azid. Azida, sous sa forme anionique, est un puissant inhibiteur d'autres protéines avec des groupes Hemo et est utilisé pour l'élimination ou la prévention de la croissance du micro-organisme dans différentes conditions.
Structure
Chez l'homme, la catalase est codée par un gène de 34 kb qui a 12 introns et 13 exons et code pour une protéine d'acide aminé 526.
La majorité des catalas étudiés sont des enzymes tétramériques avec un poids moléculaire près de 240 kDa (60 kDa pour chaque sous-unité) et chaque monomère est associé à un groupe prothétique d'hémine ou de ferroprotoporfirine.
Sa structure est constituée de quatre domaines composés de structures secondaires formées par Alfa Hhelices et des feuilles complétées par β, et des études menées dans l'enzyme du foie de l'homme et des bovins ont montré que ces protéines sont liées à quatre molécules NADPH.
Ces molécules NADPH ne semblent pas essentielles pour l'activité enzymatique de la catalase (pour la production d'eau et d'oxygène à partir de peroxyde d'hydrogène), mais il semble se rapporter à une diminution de la sensibilité de cette enzyme par rapport aux concentrations élevées de son substrat toxique.
Les domaines de chaque sous-unité de la catalase des humains sont:
Peut vous servir: caroténoïdes-Un bras N-terminal non globulaire étendu, qui fonctionne pour la stabilisation de la structure quaternaire
-Un β-baril de huit β-plits antiparallels, qui fournissent certains des résidus de jonction latérale au groupe Hemo
-Un domaine de "emballage" qui entoure le domaine extérieur, y compris le groupe Hemo et, enfin
-Un domaine avec une structure d'hélice alpha
Les quatre sous-unités, avec ces quatre domaines, sont responsables de la formation d'un canal long dont la taille est essentielle au mécanisme de reconnaissance du peroxyde d'hydrogène par l'enzyme (qui utilise des acides aminés tels que l'histidine, l'asparagine, la glutamine et l'acide aspartique ).
Les fonctions
Selon certains auteurs, la catalase remplit deux fonctions enzymatiques:
-Décomposition du peroxyde d'hydrogène dans l'eau moléculaire et l'oxygène (comme peroxydase spécifique).
-L'oxydation des donneurs de protons, tels que le méthanol, l'éthanol, de nombreux phénols formiques et de l'acide, en utilisant une mole de peroxyde d'hydrogène (comme une peroxydase non spécifique).
-Dans les érythrocytes, la grande quantité de catalase semble jouer un rôle important dans la protection de l'hémoglobine devant les agents oxydants, tels que le peroxyde d'hydrogène, l'acide ascorbique, la méthylhydrazine et d'autres.
L'enzyme présente dans ces cellules est responsable de la défense d'autres tissus avec peu d'activité de catalase par rapport aux concentrations élevées de peroxyde d'hydrogène.
-Certains insectes tels que le bombardier utilisent la catalase comme mécanisme de défense, car le peroxyde d'hydrogène se décompose et utilise le produit gazeux d'oxygène de ladite réaction pour propulser la production d'eau et d'autres composés chimiques sous forme de forme de.
-Dans les plantes, la catalase (également présente dans les peroxysomes) est l'un des composants du mécanisme de photoorerspiration, au cours de laquelle le phosphoglycate produit par l'enzyme Rubisco est utilisé pour la production de 3-phosphoglycérate.
Peut vous servir: le cycle LoosPathologies connexes chez l'homme
Les principales sources de production du substrat catalase, le peroxyde d'hydrogène, sont les réactions catalysées par les enzymes oxydases, les espèces réactives de l'oxygène et certaines cellules tumorales.
Ce composé est impliqué dans les processus inflammatoires, dans l'expression des molécules adhésives, dans l'apoptose, dans la régulation de l'agrégation plaquettaire et dans le contrôle de la prolifération cellulaire.
Lorsqu'il y a des carences de cette enzyme, des concentrations élevées de son substrat sont générées, qui produisent des lésions dans la membrane cellulaire, des défauts du transport électronique dans les mitochondries, dans le métabolisme de l'homocystéine et de l'ADN.
Parmi les maladies associées aux mutations du gène codage pour la catalase des humains, on peut mentionner:
-Diabète mellitus
-Hypertension
-Alzheimer
-Vitiligo et autres
Les références
- Agar, n., Sadrzadeh, s., Findo, P., & Eaton, J. (1986). Érythrocyte catalase. Une défense oxydante somatique? J. Lutter. Investir., 77, 319-321.
- Góth, L., Rass, p., & Payer pour. (2004). Mutations enzymatiques de la catalase et leur association avec les conceptions. Diagnostic moléculaire, 8(3), 141-149.
- Kirkman, H., & Gaetanit, G. F. (1984). Catalase: une enzyme tétramérique avec quatre molécules de NADPH. Procure. Natl. Acade. SCI. LES USAGES, 81, 4343-4347.
- Kirkman, H. N., & Gaetani, G. F. (2006). Catalase des mammifères: enzyme vénérable avec de nouveaux mystères. Tendances des sciences biochimiques, 32(1), 44-50.
- Rawn, J. D. (1998). Biochimie. Burlington, Massachusetts: Neil Patterson Publishers.
- Salomon, E., Berg, L., & Martin, D. (1999). La biologie (5e Ed.). Philadelphie, Pennsylvanie: Saunders College Publishing.
- Vinshtein, b., Melik-adamyan, w., Barynine, V., Vagin, un., & Grebenko, un. (1981). Structure tridimensionnelle de l'enzyme catalase. Nature, 293(1), 411-412.
- « Caractéristiques de lacasas, structure, fonctions
- Caractéristiques de mouvement rectiligne uniformément accélérées, formules »

