Caractéristiques de lacasas, structure, fonctions
- 3999
- 143
- Raphaël Meyer
Le les maisons, p-Dipénol: dioxygène oxydé ou benznenelio-oxygène oxydingase.
Il y a dans les plantes supérieures, dans certains insectes, dans les bactéries et dans pratiquement tous les champignons qui ont été étudiés; Sa couleur bleue caractéristique est un produit de quatre atomes de cuivre attachés à la molécule dans son site catalytique.
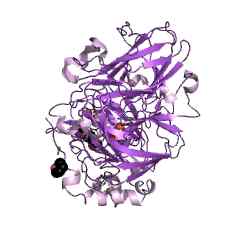
 Représentation graphique de la structure moléculaire d'une enzyme lacasa (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons)
Représentation graphique de la structure moléculaire d'une enzyme lacasa (Source: Jawahar Swaminathan et MSD Staff au European Bioinformatics Institute [Domain public] via Wikimedia Commons) Ces enzymes ont été décrites par Yoshida et des collaborateurs en 1883, lors de l'étude de la résine d'arbre Rhus Vernicifera ou "laquaire arbre" japonais, où il a été déterminé que sa fonction principale était de catalyser les réactions de polymérisation et de dépolérisation des composés.
Beaucoup plus tard, il a été découvert que, dans les champignons, ces protéines à activité enzymatique ont des fonctions spécifiques dans les mécanismes d'élimination des phénols toxiques du milieu où ils se développent, tandis que dans les plantes, ils sont impliqués dans des processus synthétiques tels que la lignification.
Les avancées scientifiques concernant l'étude de ces enzymes ont permis leur emploi au niveau industriel, où leur capacité catalytique a été utilisée, en particulier dans les contextes de la biorestauration, de la textillerie, dans l'élimination des colorants appliqués aux textiles, dans l'industrie du papier, entre d'autres.
Les principales raisons pour lesquelles les lacasas sont si intéressantes du point de vue industriel ont à voir avec le fait que leurs réactions d'oxydation impliquent simplement la réduction de l'oxygène moléculaire et de la production d'eau comme élément secondaire.
[TOC]
Caractéristiques
Les enzymes lacasas peuvent être sécrétées ou être dans la région intracellulaire, mais cela dépend du corps qui est étudié. Malgré cela, la plupart des enzymes analysées (à l'exception de certaines protéines de certains champignons et insectes) sont des protéines extracellulaires.
Peut vous servir: les protobièresDistribution
Ces enzymes, comme mentionnées ci-dessus, sont principalement dans les champignons, dans les plantes supérieures, dans les bactéries et dans certaines espèces d'insectes.
Parmi les plantes où leur existence a été démontrée figurent des pommiers, des asperges, des pommes de terre, des poires, des mangues, des pêches, des pins, des prunes, entre autres. Les insectes qui expriment les lacasas appartiennent principalement aux genres Bombyx, Calliphora, Diploptera, Drosophila, Musca, Papilio, Rhodnius, et autres.
Les champignons sont les organismes dont la plus laquille et la variété de lacas ont été isolées et étudiées, et ces enzymes sont présentes dans les ascomycetes et la deutéromice et les basidiomycètes.
Catalyse
La réaction que les lacases catalyser.
Le résultat de la réaction catalytique est la réduction d'une molécule d'oxygène à deux molécules d'eau et l'oxydation, en même temps, de quatre molécules de substrat pour produire quatre radicaux réactifs libres.
Les radicaux libres intermédiaires peuvent se lier et former des dímeros, des oligomères ou des polymères, il est donc dit que les lacasas catalysent les réactions de polymérisation et la "dépolimérisation".
Structure
Les lacasas sont des glycoprotéines, c'est-à-dire que ce sont des protéines qui ont des oligosaccharides covalemment unies à la chaîne polypeptidique, et celles-ci représentent entre 10 et 50% du poids total de la molécule (sur les enzymes végétales, le pourcentage peut être un peu plus élevé).
La partie glucidique de ce type de protéine contient des monosaccharides tels que le glucose, le galactose, la fucosa, l'arabineux et certaines hexosamines, et on pense que la glycosylation a des fonctions importantes dans la sécrétion, la sensibilité protéolytique, l'activité, la rétention de cuivre et la stabilité thermique de la protéine.
Généralement, ces enzymes se trouvent dans la nature en tant que monomères ou homodimistes et le poids moléculaire de chaque monomère peut varier entre 60 et 100 kDa.
Le centre catalytique des lacasas est composé de quatre atomes de cuivre (Cu), qui accordent à la molécule en général une couleur bleue due à l'absorption électronique qui se déroule dans les liaisons en cuivre (Cu-Cu).
Peut vous servir: allométrieLes lacases végétales ont des points isoélectriques avec des valeurs proches de 9 (assez basiques), tandis que les enzymes fongiques se trouvent entre les points isoélectriques de 3 et 7 (ce sont donc des enzymes qui fonctionnent dans des conditions acides).
Isoenzymes
De nombreux champignons qui produisent des lacases en ont également des isoformes, qui sont codées par le même gène ou par des gènes différents. Ces isoenzymes diffèrent les uns des autres en termes de stabilité, de leur pH et de leur température optimaux pour catalyser et en termes d'affinité pour différents types de substrat.
Dans certaines conditions, ces isoenzymes peuvent avoir des fonctions physiologiques différentes, mais cela dépend de l'espèce ou de la condition dans laquelle il habite.
Les fonctions
Certains chercheurs ont montré que les lacasas sont impliqués dans la "sclérotisation" de la cuticule dans les insectes et l'assemblage de spores résistantes à la lumière ultraviolette dans les micro-organismes du genre Bacille.
Dans les plantes
Dans les organismes végétaux, les lacasas participent à la formation de la paroi cellulaire, dans les processus de lignification et de «détriment» (perte ou désintégration de la lignine); Et en outre, ils ont été liés à la détoxification des tissus en oxydant les phénols antifongiques ou la désactivation des phytoexines.
En champignons
De manière significative dans ce groupe d'organismes, les lacasas participent à une variété de processus cellulaires et physiologiques. Parmi eux, la protection des champignons pathogènes des tanins et des «phytoexins» végétaux peut être mentionné; On peut donc dire que, pour les champignons, ces enzymes sont des facteurs de virulence.
Les lacasas ont également des fonctions de morphogenèse et de différenciation des structures de résistance et des spores de basidiomycètes, ainsi que dans la biodégradation de la lignine dans des champignons qui dégradent les tissus des espèces ligneuses.
Il peut vous servir: différences entre la science et la technologieDans le même temps, les lacases participent à la formation de pigments du mycélium du système immunitaire des hôtes infectés par des champignons pathogènes.
Dans l'industrie
Ces enzymes particulières sont employées industriellement à plusieurs fins, mais les plus remarquables correspondent aux industries textiles et aux frontières et aux processus de biorestauration et de décontamination des produits d'eaux usées d'autres processus industriels.
Ponctuellement, ces enzymes sont fréquemment utilisées pour l'oxydation des phénols et leurs dérivés présents dans les eaux contaminées avec des déchets industriels, dont les produits de catalyse sont insolubles (polymérisés) et précipités, ce qui les rend facilement séparables.
Dans l'industrie alimentaire, ils ont également une certaine importance car l'élimination des composés phénoliques est nécessaire pour la stabilisation de boissons telles que le vin, la bière et les jus naturels.
Ils sont utilisés dans l'industrie des cosmétiques, dans la synthèse chimique de nombreux composés, dans la biorestauration des sols et en nanobiotechnologie.
Les plus utilisés sont les lacasas de champignons, mais récemment, il a été déterminé que les lacasas bactériens ont des caractéristiques plus remarquables du point de vue industriel; Ils sont capables de travailler avec la plus grande variété de substrats et à des gammes de températures et de pH beaucoup plus larges, en plus d'être beaucoup plus stables devant les agents inhibiteurs.
Les références
- Claus, H. (2004). Laccases: structure, réactions, distribution. Micron, 35, 93-96.
- Couto, s. R., Luis, J., & Herrera, t. (2006). Applications industrielles et biotechnologiques des laccases: une revue. Avances de biotechnologie, 24, 500-513.
- Madhavi, V., & Lele, s. S. (2009). Laccase: propriétés et applications. Biorés, 4(4), 1694-1717.
- Riva, s., Molecolare, r., & Bianco, V. M. (2006). Laccases: enzymes bleues pour la chimie verte. Tendances de la biotechnologie, 24(5), 219-226.
- Singh, P., Bindi, c., & Arunika, g. (2017). Laccase bactérienne: mise à jour récente sur la production, les propriétés et les applications industrielles. biotechnologies, 7(323), 1-20.
- « Quels sont les vecteurs coplanares? (Avec des exercices résolus)
- Caractéristiques de la catalase, structure, fonctions, pathologies »

