Structure de carbure de calcium (CAC2), propriétés, obtention, utilisations

- 2859
- 379
- Adam Mercier
Il Carbure de calcium Il s'agit d'un composé inorganique formé par des éléments de calcium (CA) et de carbone (c) (C). Sa formule chimique est CAC2. C'est un solide qui peut être incolore à blanc jaunâtre ou grisâtre, et même noir en fonction des impuretés qu'il contient.
L'une de ses réactions chimiques les plus importantes du CAC2 est celui qui se produit avec l'eau h2Ou, dans laquelle la forme acétylène hc≡ch. Par conséquent, il est utilisé pour obtenir de l'acétylène industriellement. En raison de la même réaction de l'eau est utilisée pour mûrir les fruits, dans de faux canons et dans les éruptions navales.
 Carbure de calcium CAC2 solide. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons.
Carbure de calcium CAC2 solide. Ondřej Mangl / Pub Domain. Source: Wikimedia Commons. La réaction du CAC2 Avec l'eau produit également une boue utile pour préparer le clinker (une composante de ciment), qui produit moins de dioxyde de carbone (CO2) Si comparé à la méthode traditionnelle de production de ciment.
Avec de l'azote (n2) Le carbure de calcium forme le cyanamide de calcium, qui est utilisé comme engrais. Le cac2 Il est également utilisé pour éliminer le soufre de certains alliages métalliques.
Il y a quelque temps le CAC2 Il a été utilisé dans les lampes en carbure SO.
[TOC]
Structure
Le carbure de calcium est un composé ionique et est formé par l'ion CA Calcio2+ et le carbure ou l'acétyluro C22-. L'ion carbure est composé de deux atomes de carbone unis par une triple liaison.
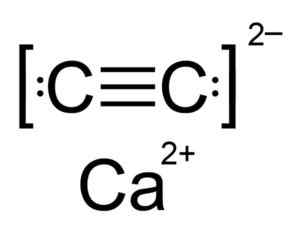 Structure chimique du carbure de calcium. Auteur: Hellbus. Source: Wikimedia Commons.
Structure chimique du carbure de calcium. Auteur: Hellbus. Source: Wikimedia Commons. La structure cristalline du CAC2 Il est dérivé du cubique (comme le chlorure de sodium naCl), mais comme l'ion c22- La structure est allongée est déformée et devient tétragonale.
Nomenclature
- Carbure de calcium
- Carbure de calcium
- Acétylure de calcium
Propriétés
État physique
Solide cristallin qui, pure, est incolore, mais s'il est contaminé par d'autres composés, il peut être jaunâtre ou grisâtre à noir.
 Carbure de calcium CAC2 Avec des impuretés. Leiem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Carbure de calcium CAC2 Avec des impuretés. Leiem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Poids moléculaire
64 0992 g / mol
Il peut vous servir: Alilo: unité allyique, carbocation, radical, exemplesPoint de fusion
2160 ºC
Point d'ébullition
Le cac2 bouillonne à 2300 ºC avec décomposition. Le point d'ébullition doit être mesuré sous une atmosphère inerte, c'est-à-dire sans oxygène ni humidité.
Densité
2,22 g / cm3
Propriétés chimiques
Le carbure de calcium réagit avec de l'eau pour former de l'hydroxyde de calcium HC≡CH et CA (OH)2:
Cac2 + 2 h2O → HC≡CH + CA (OH)2
L'acétylène est inflammable, donc en présence d'humidité le CAC2 Ça peut être inflammable. Cependant, quand il est sec, ce n'est pas.
 Carbure de calcium CAC2 Avec l'eau hc≡ch acétylène forme, composé inflammable. Kristina Kravets / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Carbure de calcium CAC2 Avec l'eau hc≡ch acétylène forme, composé inflammable. Kristina Kravets / CC By-S (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Le carbure de calcium réagit avec l'azote n2 Pour former CACN Calcio Cyanamide2:
Cac2 + N2 → CACN2 + C
Obtention
Le carbure de calcium est produit industriellement dans un four à arc électrique basé sur un mélange de carbonate de calcium (CACO3) et le charbon (c) qui est soumis à une température de 2000 ° C. La réaction est résumé comme suit:
Voleur3 + 3 C → CAC2 + CO ↑ + Co2↑
Ou aussi:
Cao + 3 C → CAC2 + Co ↑
Dans un four à arc électrique, il y a un arc d'électricité entre deux électrodes en graphite, qui résistent aux températures fortes qui sont formées. Un carbure de calcium avec une pureté de 80 à 85% est obtenu.
Applications
En production d'acétylène
Industriellement, la réaction en carbure de calcium avec de l'eau pour produire de l'acétylène C est utilisée2H2.
Cac2 + 2 h2O → HC≡CH + CA (OH)2
C'est l'utilisation la plus importante du carbure de calcium. Dans certains pays, l'acétylène est très apprécié, car il permet de produire du chlorure de polyvinyle, qui est un type de plastique. De plus, l'acétylène sert à effectuer des soudures à des températures élevées.
 HC≡CH Métaux de flamme d'acétylène à des températures très élevées. Auteur: ShutterBug75. Source: Pixabay.
HC≡CH Métaux de flamme d'acétylène à des températures très élevées. Auteur: ShutterBug75. Source: Pixabay. En réduisant les émissions de CO2
Les restes obtenus à partir de l'obtention d'acétylène à partir de CAC2 (également appelé «boues de carbure de calcium» ou «résidus de carbure de calcium»), ils servent à être utilisés pour obtenir un clinker ou un béton.
Peut vous servir: applications technologiques de l'émission électronique des atomesLa boue de carbure de calcium a une teneur élevée en hydroxyde de calcium (CA (OH)2) (environ 90%), un peu de carbonate de calcium (CACO3) et a un pH supérieur à 12.
 Les résidus de carbure de calcium peuvent être utilisés dans l'activité de construction pour préparer le béton, réduisant ainsi la génération de CO2 de cette industrie. Auteur: Engin Akyurt. Source: Pixabay.
Les résidus de carbure de calcium peuvent être utilisés dans l'activité de construction pour préparer le béton, réduisant ainsi la génération de CO2 de cette industrie. Auteur: Engin Akyurt. Source: Pixabay. Pour ces raisons, vous pouvez réagir avec Sio2 ou al2SOIT3 formant un produit similaire à celui obtenu par le processus d'hydratation de ciment.
L'une des activités humaines qui produit le plus de co-émissions2 C'est l'industrie de la construction. Le CO2 Il est généré à l'est du carbonate de calcium pendant la réaction pour former du béton.
Utilisation de la boue de carbure de calcium pour remplacer le carbonate de calcium (CACO3) Il a été constaté que les co-émissions sont réduites2 En 39%.
Dans l'obtention du cyanamide de calcium
Le carbure de calcium est également utilisé industriellement pour obtenir le cyanamide de calcium CACN2.
Cac2 + N2 → CACN2 + C
Le cyanamide de calcium est utilisé comme engrais, car avec l'eau du sol, il devient le cyanamide H2N = C = N, qui fournit de l'azote aux plantes, un nutriment essentiel pour ces.
Dans l'industrie métallurgique
Le carbure de calcium est utilisé pour éliminer les alliages tels que Ferroníquel. Le CAC est mélangé2 Avec l'alliage fondu à 1550 ° C. Le soufre réagit avec le carbure de calcium et le SULFURE DE CALCUMIQUE CAS et le charbon C:
Cac2 + S → 2 C + CAS
L'élimination du soufre est favorisée si le mélange est efficace et que la teneur en carbone en alliage est faible. Le sulfure de calcium de casclium flotte à la surface de l'alliage fondu où il opte et jeté.
Dans plusieurs utilisations
Le carbure de calcium a été utilisé dans l'élimination du soufre de fer. Aussi comme carburant dans la production d'acier et comme un puissant désoxydant.
Peut vous servir: substitution électrophile aromatique: mécanisme et exemplesIl est utilisé pour mûrir les fruits. À partir du carbure de calcium avec de l'eau, l'acétylène est généré, ce qui induit la maturation des fruits, comme les bananes.
 Les bananes peuvent mûrir à l'aide de carbure de calcium CAC2. Auteur: Alexas Photos. Source: Pixabay.
Les bananes peuvent mûrir à l'aide de carbure de calcium CAC2. Auteur: Alexas Photos. Source: Pixabay. Le carbure de calcium est utilisé dans de faux canons pour provoquer le bruit d'explosion forte qui les caractérise. Voici également la formation d'acétylène, qui explose avec une étincelle dans l'artefact.
Le cac2 Il est utilisé pour générer des signaux en haute mer dans des éruptions navales qui s'auto-estiment.
Utilisation abandonnée
Le cac2 Il a été utilisé dans les lampes en carbure SO. Le fonctionnement de ceux-ci consiste en l'eau dégoulinante sur du carbure de calcium pour former de l'acétylène, qui s'allume et fournit ainsi la lumière.
Ces lampes ont été utilisées dans les mines de charbon, mais leur utilisation a été interrompue en raison de la présence de méthane gaz4 Dans ces mines. Ce gaz est inflammable et la flamme de la lampe en carbure peut le faire tirer ou exploiter.
 Lampe en carbure de calcium CAC2. Domaine scehardt / pub. Source: Wikimedia Commons.
Lampe en carbure de calcium CAC2. Domaine scehardt / pub. Source: Wikimedia Commons. Ils étaient largement utilisés dans les mines d'ardoise, le cuivre et l'étain, ainsi que dans les premières voitures, motos et vélos, tels que les feux avant ou les phares.
Ils ont actuellement été remplacés par des lampes électriques ou même des lampes à LED. Cependant, ils sont toujours utilisés dans des pays comme la Bolivie, dans les mines d'argent Potosí.
Des risques
Carbure de calcium CAC2 Le sec n'est pas inflammable mais en présence d'humidité forme de l'acétylène, qui est.
Pour éteindre un feu en présence de CAC2 Les extincteurs d'eau, de mousse, de dioxyde de carbone ou d'halogène ne doivent jamais être utilisés. L'hydroxyde de sodium ou de calcium doit être utilisé.
Les références
- Ropp, r.C. (2013). Groupe 14 (C, SI, GE, SN et PB) Composés de la Terre alcaline. Carbures de calcium. Dans l'encyclopédie des composés terrestres alcalins. Récupéré de ScienceDirect.com.
- Pohanish, R. P. (2017). C. Calcium en carbure. Dans le manuel de Sittig de produits chimiques et de Carcinages toxiques et dangereux (septième édition). Récupéré de ScienceDirect.com.
- Soleil, H. et al. (2015). Propriétés de la resue en carbure de calcium chimiquement combattu et de son affection sur les propriétés de ciment. Matériaux 2015, 8, 638-651. NCBI a récupéré.NLM.NIH.Gouvernement.
- Nie, Z. (2016). Éco-matériaux et évaluation du cycle de vie. Étude de cas: CO2 Analyse des émissions du tintement des boues de carbure de calcium. Dans la fabrication verte et durable de matériaux avancés. Récupéré de ScienceDirect.com.
- Crundwell, F.K. Et al. (2011). Raffiner le ferronickel fondu. Retrait du soufre. En métallurgie extractive des métaux du nickel, du cobalt et du platine. Récupéré de ScienceDirect.com.
- Tressler, R.ET. (2001). Céramique structurelle et thermostructurale. Carbures. Dans l'encyclopédie de la science et de la technologie des matériaux. Récupéré de ScienceDirect.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- « 10 avantages de courir quotidiennement pour la santé
- Caractéristiques des valeurs morales, formation et exemples »

