Carbonate de sodium (NA2CO3)
- 4430
- 909
- Lucas Schneider
Nous expliquons ce que le carbonate de sodium, ses propriétés physiques et chimiques, sa structure et ses applications
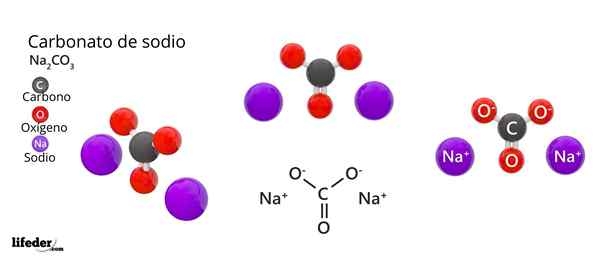
 Structure et formule de carbonate de sodium
Structure et formule de carbonate de sodium Qu'est-ce que le carbonate de sodium?
Il carbonate de sodium (N / A2CO3) C'est un sel inorganique, un métal alcalin et un acide carbonique. Il est également connu dans le monde entier sous le nom de Sosa Ash. Les lacs et les activités volcaniques ont enrichi les sols de sodium, dont les plantes étaient nourries; Ensuite, après un incendie, ces plantes répandaient les cendres de carbonate.
Comment se produit ce sel de sodium métallique? Le sodium pur a une configuration de valence [NE] 3S1. L'électron orbital 3S1 Il est facilement détaché par d'autres éléments de la nature (comme le soufre, l'oxygène, le chlore, le fluor, etc.), formant des composés minéraux où l'on stable na participe+.
Puis un+ Il s'accompagne d'autres espèces ioniques dans ces solides; Parmi ceux-ci, le carbonate de sodium n'est plus présent de la nature présente. Depuis lors, il a été utilisé dans toutes les civilisations tout au long de la période. Ces civilisations trouvaient dans cette poussière de gris.
Ces propriétés ont marqué leurs utilisations, qui maintiennent aujourd'hui les aspects traditionnels du passé, et d'autres répondent aux besoins actuels.
Le carbonate de sodium est de nature très abondante, et peut-être aussi dans d'autres territoires en dehors de la planète Terre, comme certaines lunes du système solaire.
Formule
La formule chimique du carbonate de sodium est na2CO3. Comment est-il interprété? Cela signifie que, dans le solide cristallin, pour chaque co -on32- Il y a deux ions na+.
Structure de carbonate de sodium
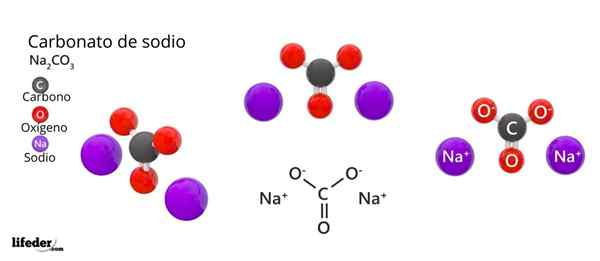
Dans l'image supérieure, la structure du NA est représentée2CO3 Anhydride (également appelé Sosa calcinada). Les sphères violettes correspondent aux ions NA+, tandis que le noir et le rouge aux ions co32-.
Les ions carbonatés ont une structure trigonale plate, avec des atomes d'oxygène à leurs sommets.
Il peut vous servir: acide cinamique: structure, propriétés, obtention, utilisationsL'image donne un panorama vu à partir d'un plan supérieur. Na ions+ Ils sont entourés de six atomes d'oxygène, à partir de Co -ions32-. C'est-à-dire dans le na2CO3 Anhydride Le sodium rencontre une géométrie de coordination octaédrique (elle est verrouillée au centre d'un octaèdre).
Cependant, cette structure est également capable d'héberger des molécules d'eau, interagissant avec les ponts d'hydrogène avec les sommets des triangles.
En fait, Na hydrate2CO3 (N / A2CO3· 10h2Ou, na2CO3· 7h2Ou, na2CO3· H2Ou, et autres) sont de plus grande abondance que le sel d'anhydride.
La thermonatrite (na2CO3· H2O), le natron (na2CO3· 10h2O) et le trona (na3(HCO3)(CO3) · 2h2Ou sont les principales sources naturelles de carbonate de sodium, en particulier le minéral Trona, représenté dans la première image.
Utilisations / applications de carbonate de sodium
Le carbonate de sodium remplit de nombreuses fonctions chez les personnes, les ménages et l'industrie, parmi ces fonctions, ce qui suit se démarque:
- Le carbonate de sodium est utilisé dans de nombreux produits de nettoyage. Cela est dû à sa capacité de désinfectante, à son pouvoir de dissoudre les graisses et à leur propriété pour adoucir l'eau. Il fait partie des détergents utilisés dans les blanchisseries, le lave-vaisselle automatique, le verre propre, les taches remuant, les gradins, etc.
- Le désinfectant du carbonate peut être utilisé sur des surfaces dures non-ruthées, telles que les planchers, les murs, la porcelaine et les baignoires, à l'exception du Fibre de verre et l'aluminium, qui peut être rayé par lui.
- Il est utilisé dans certains aliments pour éviter la tasse qui peut se produire dans ces.
- Il est présent dans plusieurs produits de soins personnels, tels que les bains moussant, les pâtes dentaires et les savons.
- Il est utilisé dans l'industrie du verre en raison de sa capacité à décomposer les silicates.
- Il est utilisé dans l'entretien des piscines, où il remplit une fonction désinfectante et régulatrice du pH.
- Chez l'homme utilisé thérapeutiquement dans le traitement de l'acidité et de la dermatite.
- En médecine vétérinaire, il est utilisé dans le traitement de la teigne et du nettoyage de la peau.
Synthèse de carbonate de sodium

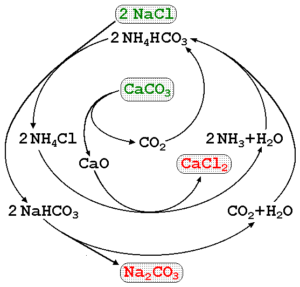
Le carbonate de sodium peut être fabriqué à l'aide de la saumure des mers et du calcaire (CACO3) Dans le processus Solvay. Dans l'image supérieure, un diagramme de processus est illustré indiquant les itinéraires de production, ainsi que les réactifs, les intermédiaires et les produits. Les réactifs sont écrits avec des lettres vertes et les produits avec des lettres rouges.
La surveillance de ces réactions peut être un peu complexe, mais l'équation globale qui indique uniquement les réactifs et les produits est:
2NACl (aq) + caco3(s) na2CO3(s) + cacl2(AC)
Le caco3 Il a une structure cristalline très stable, il exige donc constamment beaucoup d'énergie pour le décomposer en CO2. De plus, ce processus génère de grandes quantités de cacl2 (chlorure de calcium) et autres impuretés, dont les décharges affectent la qualité de l'eau et de l'environnement.
Il existe également d'autres méthodes de production de carbonate de sodium dans des champs industriels, tels que les processus Hou et LeBlanc.
Aujourd'hui, son objet de ses minéraux naturels est durable, le trona étant le plus abondant d'entre eux.
D'un autre côté, la méthode la plus traditionnelle consistait en la culture et une brûlure des plantes et des algues riches en sodium. Ensuite, les cendres ont été baignées à l'eau et soumises au chauffage jusqu'à ce que le produit. De là, a émergé les célèbres cendres de Sosa.
Propriétés de carbonate de sodium
Puis un2CO3 C'est un solide blanc hygroscopique, des toilettes, avec un poids moléculaire de 106 g / mol et une densité de 2,54 g / ml à 25 ° C.
Ses propriétés changent à mesure qu'une molécule d'eau incorpore dans sa structure cristalline. Comme l'eau peut former des ponts d'hydrogène et que les ions «espace ouvert» entre eux, le volume du verre augmente et la densité de l'hydrate diminue. Par exemple, pour Na2CO3· 10h2Ou, sa densité est de 1,46 g / ml.
Peut vous servir: réaction réversible: caractéristiques et exemplesPuis un2CO3 fond à 851 ºC, en décomposant selon l'équation suivante:
N / A2CO3(s) => na2Ou (s) + co2(g)
Encore une fois, malgré les co ions32- et na+ Ils diffèrent en tailles, leurs interactions électrostatiques sont très efficaces et maintiennent un réseau cristallin stable.
Les molécules d'eau «entravent» ces interactions et, par conséquent, les hydrates sont plus susceptibles de décomposer que l'anhydride.
C'est un sel de base; c'est-à-dire que dissous dans l'eau génère une solution avec un pH supérieur à 7. Cela est dû à l'hydrolyse du CO32-, dont la réaction libère oh- au milieu:
CO32-(AC) + H2Ou (l) HCO3-(Ac) + oh-(AC)
Il est très soluble dans l'eau et les solvants polaires, comme le glycérol, la glycérine, l'acétone, les acétates et l'ammoniac liquide.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. Dans les éléments du groupe 1. (Quatrième édition., p. 265). Mc Graw Hill.
- Scifun.org. (2018). Hydrogène de sodium et carbonate de sodium. Récupéré de Scifun.org
- Wikipédia. (2018). Le carbonate de sodium. Récupéré de.Wikipédia.org
- Se publier. (2018). Le carbonate de sodium. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement
- Ciner Resources Corporation. (2018). Carbonate de sodium. Ciner a récupéré.nous.com
- Peltier K. (3 juillet 2018). Tout ce que vous devez savoir sur la carbonite de sodium. Récupéré le 8 avril 2018 de: thespruce.com
- Industries nettes. (2018). Carbonate de sodium - Utilisations du carbonate de sodium. Récupéré le 8 avril 2018 de: Science.jank.org

