Structure, fonctions et mécanisme d'action de la calmoduline
- 4656
- 812
- Raphaël Charles
Calmoduline C'est un terme qui signifie «protéine modulée en calcium» et fait référence à une petite protéine intracellulaire qui possède la propriété de l'ion calcique (Ca ++) et pour médier bon nombre de ses actions intracellulaires. L'origine du mot est née de la combinaison de mots anglais «calcium», «modulé» et «protéine» qui, lorsqu'il est ensemble, dérive en CHAUXCium ModulProtégerDans.
Parmi les éléments minéraux qui font partie de la constitution des organismes animaux, le calcium, suivi du phosphore, est très différent des plus abondants, car l'os est formé par le dépôt dans sa matrice de grandes quantités de sels minéraux formés à partir de ce ion.
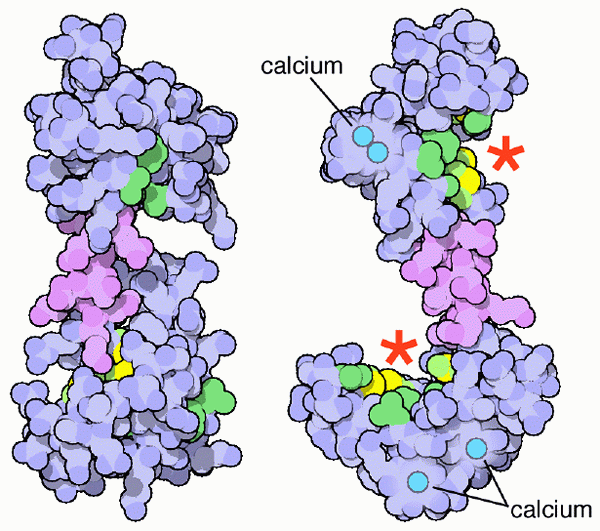
 Schéma de calmoduline et ses sites Union Calcium (Source: PDB [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Schéma de calmoduline et ses sites Union Calcium (Source: PDB [CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Bien sûr, ces sels minéraux de calcium sont essentiels pour la constitution et la conformation du système squelettique des vertébrés, mais c'est la forme ionisée de calcium (Ca ++) en solution dans les fluides corporels qui devient une importance physiologique pertinente pour la vie de la vie La vie des organismes.
Ce cation, avec deux charges électriques positives dans sa structure, peut agir en tant que convoyeur actuel lors du passage à travers la membrane cellulaire et modifier son niveau de potentiel électrique dans de nombreuses cellules excitables du corps, principalement dans le muscle cardiaque.
Mais une plus grande pertinence physiologique est le fait que de nombreuses réactions régulateurs cellulaires tirées par des stimuli externes, tels que des neurotransmetteurs, des hormones ou d'autres facteurs physiques ou biochimiques, sont des espèces de cascades métaboliques dans lesquelles plusieurs protéines participent séquentiellement, dont certaines sont des enzymes qui sont des enzymes qui sont des enzymes qui sont des enzymes dont ils ont besoin de calcium pour l'activation ou l'inactivation.
Il est alors dit dans ces cas que le calcium agit comme un deuxième messager dans une cascade métabolique visant à avoir un résultat final qui deviendrait la réponse cellulaire nécessaire pour répondre à un besoin détecté à un autre niveau autre que la cellule elle-même, et qui nécessite d'elle Cette réponse particulière.
Le calcium peut agir directement sur sa cible biochimique pour influencer son activité, mais elle nécessite souvent la participation d'une protéine avec laquelle elle doit être unie pour pouvoir exercer son effet sur la ou les protéines pour modifier. La calmoduline est l'une de ces protéines médiatrices.
[TOC]
Structure
Calmoduline, d'une grande ubiquité, car elle est exprimée dans presque tous les types cellulaires d'organismes eucaryotes, c'est une petite protéine acide d'environ 17 kDa.
Peut vous servir: canaux ioniques: structure, fonctions, typesIl s'agit d'une protéine monomère, c'est-à-dire qu'elle est formée par une seule chaîne polypeptidique, qui adopte à son terminal, la forme des domaines globulaires unis les uns par une autre par une hélice Alpha. Chaque domaine globulaire a deux raisons connues sous le nom d'EF Hand (de l'anglais Ef Main) qui sont typiques des protéines qui se lient au calcium.
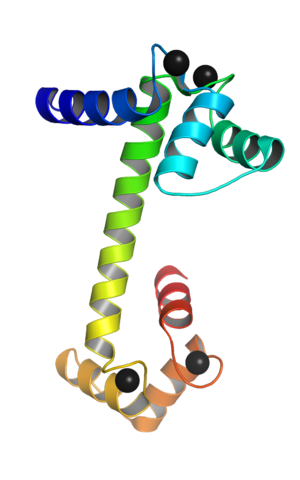 Calmoduline liée aux ions calcium (source: webridge [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons)
Calmoduline liée aux ions calcium (source: webridge [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0)] via Wikimedia Commons) Ces motifs topologiques «EF» représentent une sorte de structures supersecundaria; Ils sont liés les uns aux autres, dans chaque domaine globulaire, par une région d'une grande flexibilité et dans chacun d'eux, il y a un site de jonction pour le Ca ++, qui lance 4 sites au total pour chaque molécule de calmoduline.
L'union des ions calcium, avec une charge positive, est possible grâce à la présence de déchets d'acides aminés avec des chaînes latérales chargées négativement dans les sites de l'Union calcique du calcium de la calmoduline. Ce déchet est trois aspartates et un glutamate.
Fonctions de la calmoduline
Toutes les fonctions jusqu'à présent connues pour la calmoduline sont encadrées dans un groupe d'actions favorisées par les augmentations du calcium cytosolique produit par son entrée à partir de l'espace extracellulaire ou de sa sortie des dépôts intracellulaires: mitochondries et réticulum endoplasmique.
De nombreuses actions de calcium sont remplies par cet ion agissant directement sur ses protéines blanches, qui peuvent être de nature et de fonctions diverses. Certaines de ces protéines ne peuvent pas être directement influencées, mais nécessitent que le calcium rejoigne la calmoduline et c'est ce complexe qui agit sur la protéine influencée par l'ion.
On dit de ces protéines blanches qui dépendent du calcium-calmoduline et parmi lesquelles des dizaines d'enzymes, telles que les protéines, la protéinphosphase, les nucléotides cyclasse et les phosphodiestérases; Tous impliqués dans d'innombrables fonctions physiologiques qui incluent:
- Métabolisme
- Transport de particules
- Mobilité viscérale
- Sécrétion de substance
- Fertilisation des ovules
- Expression génétique
- Proliferation cellulaire
- L'intégrité structurelle des cellules
- Communication intercellulaire, etc.
Parmi les protéines dépendantes de la calmoduline sont citées: la Cinase de la chaîne légère de la myosine (MLCK), la Cinase Phosphorylase et le Ca ++ / Calmodulin Cinasas I, II et III.
Ainsi, les informations codées par les signaux de calcium (augmentation ou diminution de sa concentration intracellulaire) est «déchiffrer» par cette protéines et d'autres protéines de l'union de calcium, qui font des signaux un changement biochimique; En d'autres termes, la calmoduline est une protéine intermédiaire dans les processus de signalisation dépendants du calcium.
Peut vous servir: GLUT 2: caractéristiques, structure, fonctionsMécanisme d'action
La calmoduline est une protéine très polyvalente, car ses protéines "cibles" sont considérablement diverses sous forme, séquence, taille et fonction. Puisqu'il s'agit d'une protéine qui fonctionne comme un «capteur» des ions calcium, son mécanisme d'action dépend des changements induits dans sa structure et / ou sa conformation une fois qu'il rejoint quatre de ces ions.
Ses mécanismes d'action peuvent être illustrés en examinant brièvement leur participation à quelques processus physiologiques tels que la contraction du muscle lisse viscéral et l'adaptation aux odeurs subies par les cellules de nez de la muqueuse olfactive dans le nez.
Calmoduline et contraction musculaire lisse
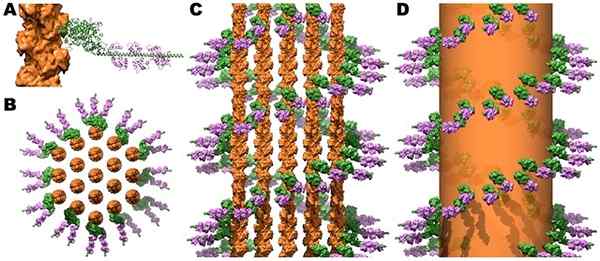 Structure des ponts croisés de la myosine et de la calmoduline dans les faisceaux d'actine microvolant. Source: Jeffrey W. Brown, C. James McKnight [CC par (https: // CreativeCommons.Org / licences / par / 3.0)]
Structure des ponts croisés de la myosine et de la calmoduline dans les faisceaux d'actine microvolant. Source: Jeffrey W. Brown, C. James McKnight [CC par (https: // CreativeCommons.Org / licences / par / 3.0)] La contraction des muscles squelettiques et cardiaques est déclenchée lorsque l'augmentation du Ca ++ cytosolique atteint des niveaux supérieurs à 10 à 6 mol / L et que cet ion se lie à la troponine C, qui subit des modifications à celles qui affectent la tropomiosine. À son tour, la tropomiosine se déplace et révèle dans l'actine ses sites syndicaux avec la myosine, dérivant que le processus contractile déclenche.
Dans le muscle lisse, il n'y a pas de troponine C, et l'augmentation de Ca ++ au-dessus du niveau indiqué favorise son union avec la calmoduline. Le complexe de Ca-Calmoduline actif à la Cinase de la chaîne légère de la myosine (MLCK), qui à son tour phosphoryle en cette chaîne légère, active la myosine et déclenche le processus contractile.
L'augmentation du Ca ++ est donnée par son entrée de l'extérieur ou la sortie du réticulum sarcoplasmique par l'action de l'inositol tryphosphate (IP3) libéré par la phospholipase C dans la cascade activée par les récepteurs couplés par la protéine GQ GQ. La relaxation se produit lorsque le Ca ++, par action de transport, est retiré du cytosol et revient sur ses sites source.
Une différence importante entre les deux types de contraction est que dans les muscles striés (cardiaque et squelettique), le Ca ++ induit des changements allesthériques lors de la joie de sa protéine, la troponine, tandis que dans la douceur, les changements produits par la Ca-Calmoduline sont covalents et impliqués impliquer la phosphorylation de la myosine.
Par conséquent, une fois l'action Ca ++ terminée, la participation d'une autre enzyme qui supprime le phosphate ajouté par la CINASA est requise. Cette nouvelle enzyme est la phosphatase de la chaîne légère de la myosine (MLCP) dont l'activité ne dépend pas de la calmoduline, mais est régulée par d'autres routes.
En fait, le processus de muscle lisse contractile ne cesse pas, mais le degré de contraction est maintenu à un niveau intermédiaire résultant l'équilibre des actions des deux enzymes, le MLCK contrôlé par le Ca ++ et la Calmoduline, et le MLCP soumis à d'autres contrôles réglementaires.
Peut vous servir: PachyneAdaptation dans les capteurs olfactifs
La sensation odorante se déclenche lorsque les récepteurs olfactifs situés dans les cils de cellules situés à la surface de la muqueuse olfactive sont activées.
Ces récepteurs sont couplés à une protéine G hétérotrophe connue sous le nom de "golf" (protéine olfactive G), qui a trois sous-unités: "αolf", "ß" et "γ".
Lorsque les récepteurs olfactifs sont activés en réponse à une odeur, les sous-unités de cette protéine sont dissociées et la sous-unité «αolf» active l'enzyme de l'adénylciclase, produisant un monophosphate cyclique d'adénosine (AMPC).
L'AMPC active les canaux de type CNG (activés par des nucléotides cycliques) pour le calcium et le sodium. Ces ions entrent dans la cellule, le dépolarisent et provoquent le début des potentiels d'action dont la fréquence déterminera l'intensité de l'odeur.
Le calcium qui entre, qui a tendance à dépolariser la cellule, a un effet antagoniste de la rétroaction négative, un peu plus tard, en rejoignant la calmoduline et entre eux fermant le canal et en éliminant le stimulus dépolarisant, malgré le fait que le stimulus odorant persiste persiste. C'est ce qu'on appelle l'adaptation du capteur.
Calmoduline dans les plantes
Les plantes réagissent également aux différences de concentration intracellulaire des ions calcium au moyen de la protéine de la calmoduline. Dans ces organismes, les calmodulalines partagent de nombreuses caractéristiques structurelles et fonctionnelles avec leurs homologues chez les animaux et les levures, bien qu'ils diffèrent dans certains aspects fonctionnels.
Par exemple, la calmoduline dans les plantes rejoint de courtes séquences de peptides au sein de ses protéines blanches, induisant des changements structurels qui modifient leurs activités en réponse aux variations de calcium internes.
Dans quelle mesure le contrôle de la calmoduline dans les procédés analogues des plantes auxquels ils se produisent chez les animaux, est quelque chose qui fait encore l'objet de discussions aujourd'hui.
Les références
- Brenner B: Musculatur, dans: Physiologie, 6e Ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Ganong WF: base moléculaire de la physiologie médicale, dans: dans: Revue de la physiologie médicale, 25e ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall Ji: Introduction à l'endocrinologie, dans: Manuel de physiologie médicale, 13e éd, AC Guyton, JE Hall (éd.). Philadelphie, Elsevier Inc., 2016.
- Kaup UB, Müller F: Système Olfactorisches, dans: Physiologie, 4e éd; P Deetjen et al (eds). München, Elsevier GmbH, Urban & Fischer, 2005.
- Korbmacher C, Greger R, Brenner B, Silbernagl S: Die Zelle als Grundbaustein, dans: Physiologie, 6e Ed; R Klinke et al (eds). Stuttgart, Georg Thieme Verlag, 2010.
- Zielinski, R. ET. (1998). Calmoduline et protéines de liaison à la calmoduline chez les plantes. Revue annuelle de la biologie des plantes, 49 (1), 697-725.
- « Modèles et exemples du patrimoine non mensuel
- Isolement des micro-organismes techniques et importance »

