Équilibrage des équations chimiques
- 4503
- 1132
- Jade Duval
Quelle est l'équilibrage des équations chimiques?
L'équilibrage des équations chimiques est une opération mathématique qui est effectuée pour maintenir la loi de conservation de la matière dans les réactions. La matière n'est pas créée ou détruite. Par conséquent, le nombre d'atomes avant et après une réaction chimique doit être le même, à la fois dans les réactifs et dans les produits.
Pour équilibrer une équation chimique, vous devez compter les atomes avant et après la flèche. Si les chiffres coïncident, cela signifie que la réaction est équilibrée. Sinon, il sera nécessaire de faire correspondre ces nombres en modifiant les coefficients stœchiométriques par essais et erreurs, ce qui est la méthode la plus simple et la plus intuitive pour l'équilibre.
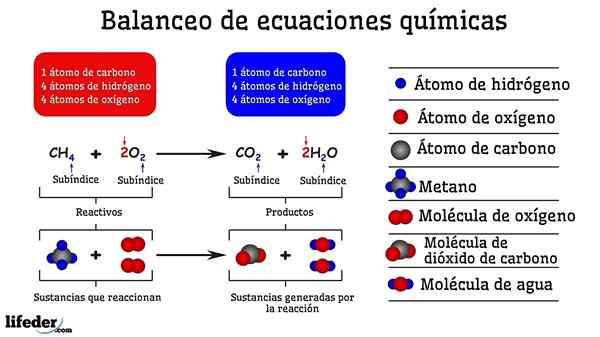
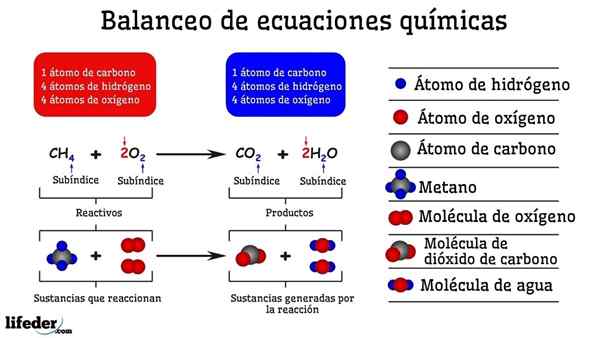 Exemple d'équilibrage chimique de la réaction entre le méthane et deux molécules d'oxygène
Exemple d'équilibrage chimique de la réaction entre le méthane et deux molécules d'oxygène Lorsqu'il est équilibré par des essais et des erreurs, c'est comme s'ils avaient été retirés ou ajoutés des atomes dans l'un des deux côtés de la subbaja. Jusqu'à ce que la subbaja ne soit pas suspendue horizontalement, l'équation chimique ne sera pas complètement équilibrée. Il ne peut y avoir plus (créer de matière) ou moins d'atomes (détruire la matière) sur n'importe quel côté.
Exemples d'équilibrage faciles d'équations
Dans les exemples suivants, vous verrez des équations chimiques équilibrées ou faciles à équilibrer. Tous doivent avoir en commun que le nombre d'atomes, pour chacun des éléments, sera le même avant et après la flèche une fois que l'équation chimique aura été équilibrée.
Oxydation du mercure
2hg + o2 → Hg2SOIT2
Nous avons deux éléments: le mercure (Hg) et l'oxygène (O). Nous exprimons le nombre de leurs atomes avant (réactifs) puis (produits) de la flèche:
Hg: 2 (à gauche) - 2 (à droite)
Il peut vous servir: fraction molaire: comment il est calculé, exemples, exercicesO: 2 (à gauche) - 2 (à droite)
L'équation est équilibrée car les atomes Hg et ou sont les mêmes des deux côtés de la flèche.
Combustion d'hydrogène
H2 + SOIT2 → H2SOIT
Nous avons à nouveau deux éléments: l'hydrogène (H) et l'oxygène (O). Répéter l'étape précédente:
H: 2 - 2
O: 2 - 1
Sur le côté gauche, il y a plus un oxygène que à droite. Nous devons donc ajouter un autre bon oxygène. Pour ce faire, nous modifions les coefficients stœchiométriques, qui sont les nombres qui accompagnent et précèdent les formules. Si nous plaçons un 2 devant H2Ou nous donnera:
H2 + SOIT2 → 2H2SOIT
H: 2 - 4
O: 2 - 2
L'oxygène est équilibré. Mais pas d'hydrogènes. Vous devez maintenant ajouter deux hydrogènes à gauche:
2h2 + SOIT2 → 2H2SOIT
H: 4 - 4
O: 2 - 2
Et l'équation est enfin équilibrée: le même nombre de h et ou avant et après la flèche.
Notez que les coefficients stoechiométriques (2 pour h2 et 1 pour le o2) multiplier les indices des formules. Cette multiplication nous donnera le nombre total d'atomes pour un élément spécifique.
Réduction du magnésium
Mg (non3)2 + 2li → mg + 2lino3
Nous évaluons les nombres d'atomes pour chaque élément:
Mg: 1 - 1
Li: 2 - 2
N: 2 - 2
O: 6 - 6
L'équation chimique est déjà équilibrée et il n'est pas nécessaire de l'équilibrer.
Exercices résolus
Avant de procéder à l'équilibre d'une équation, il est toujours nécessaire de confirmer s'il n'est plus équilibré. Cela dit, nous procédons à l'exercice suivant:
Exercice 1
Équilibré ou pas?
Foi2SOIT3 + H2O → Faith (OH)3
Nous avons trois éléments: fer (foi), hydrogène et oxygène. Une suggestion au moment des équations d'équilibre est de commencer à compter le nombre d'atomes de l'élément moins abondant dans l'équation; qui est généralement différent de H et O. Ainsi, nous comptons d'abord les atomes de la foi:
Il peut vous servir: salicylate de méthyleFoi: 2 - 1
Indice 3 de (OH)3 Ne multipliez pas la foi à gauche. Pour H et O nous avons:
H: 2 - 3
O: 4 - 3
Tous les éléments sont déséquilibrés.
Balançant
Avant même d'équilibrer H et O, nous devons équilibrer les atomes de la foi: l'élément le moins abondant, car il n'y a guère 3 foi, contrairement à 5 h et 7 ou 7 ou 7. Vous devez donc ajouter une foi à droite:
Foi: 2 - 2
Ce qui est égal à mettre un 2 coefficient stoichiométrique devant la foi (OH)3. L'équation restera:
Foi2SOIT3 + H2O → 2FE (OH)3
Foi: 2 - 2
H: 2 - 6
O: 4 - 6
Mais les H et O ou continuent déséquilibrés. Un H2Ou contribuer 2 h et nous manquons de 4 h. Par conséquent, nous ajouterons deux autres h2Ou pour nous d'avoir trois h2SOIT:
Foi2SOIT3 + 3h2O → 2FE (OH)3
Et nous évaluons à nouveau:
Foi: 2 - 2
H: 6 - 6
O: 6 - 6
Notez comment ils les équilibraient une fois que nous avons équilibré le H. L'équation est enfin équilibrée.
Exercice 2
Équilibré ou pas?
Ch4 + SOIT2 → CO2 + H2SOIT
Nous évaluons le nombre d'atomes pour tous les éléments actuels:
C: 1 - 1
H: 4 - 2
O: 2 - 3
Le carbone est équilibré, mais il ne se produit pas avec l'hydrogène et l'oxygène. L'équation est déséquilibrée.
Balançant
Comme le C est équilibré, nous ne voulons pas modifier les coefficients stœchiométriques de CH4 ou co2. Du moins pas en principe.
Nous concentrons notre attention sur H et O, en particulier sur H. Parce que? Parce que voir l'équation, il est plus facile d'équilibrer H avant ou. Nous devons ajouter 2 h à droite, plaçant un coefficient 2 devant H2SOIT:
Ch4 + SOIT2 → CO2 + 2h2SOIT
C: 1 - 1
H: 4 - 4
O: 2 - 4
C et H sont équilibrés. Nous sommes laissés 2 ou à gauche. Si chacun ou2 contribue 2 ou, nous ajouterons un ou2 en plus pour qu'ils soient 4 ou à gauche. C'est la même chose que de placer un coefficient 2 devant le o2:
Peut vous servir: oxyde de soufreCh4 + 22 → CO2 + 2h2SOIT
C: 1 - 1
H: 4 - 4
O: 4 - 4
Et l'équation est enfin équilibrée.
Exercice 3
Équilibré ou pas?
N2 + H2 → NH3
Nous évaluons nos deux éléments n et h:
N: 2 - 1
H: 2 - 3
L'équation n'est pas équilibrée.
Balançant
Nous commençons à équilibrer le n, l'élément différent de H. Nous manquons d'un droit, et comme chaque NH3 contribue 1 n, nous devons ajouter un autre NH3 Avoir 2 n:
N2 + H2 → 2NH3
N: 2 - 2
H: 2 - 6
Et maintenant il nous manque la gauche. Si chaque h2 Contribuer 2 h à l'équation, alors nous devons en ajouter deux autres pour qu'il y ait 6 h. C'est la même chose que de placer un coefficient stoechiométrique 3 devant H2:
N2 + 3h2 → 2NH3
N: 2 - 2
H: 6 - 6
Et l'équation chimique est enfin équilibrée.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- CHIMISTER BOOLISTexts. (23 novembre 2020). Comment écrire des équations chimiques équilibrées. Récupéré de: Chem.Bibliothèque.org
- Wikipédia. (2020). Équation chimique. Récupéré de: dans.Wikipédia.org
- Principes de chimie. (s.F.). Écriture et équilibrer les équations chimiques. [PDF]. Récupéré de: Web.Ung.Édu
- Phet. (s.F.). Équilibrage des équations chimiques. Récupéré de: Phet.Colorado.Édu
- Armando Marín B. (s.F.). Chimie générale: équilibre des équations. [PDF]. Récupéré de: DEPA.Finesse.Unam.mx

