Chaleur latente
- 645
- 53
- Louna Baron
Qu'est-ce que la chaleur latente?
La chaleur latente est la quantité de chaleur qui doit absorber ou détacher une substance pour modifier la condition physique ou la phase, en maintenant la température constante pendant ce processus. La chaleur fournie ou libérée ne se manifeste pas, elle ne "se sent" pas comme d'habitude dans une variation de température; D'où le terme de chaleur latente.
Le mot latent vient du mot latin "latenns" qui signifie caché, donc la chaleur latente se comporte comme si elle n'existait pas lorsque la température est constante. Mais il y a: ce qui se passe, c'est qu'il est complètement consommé dans le changement de phase ou de condition physique.
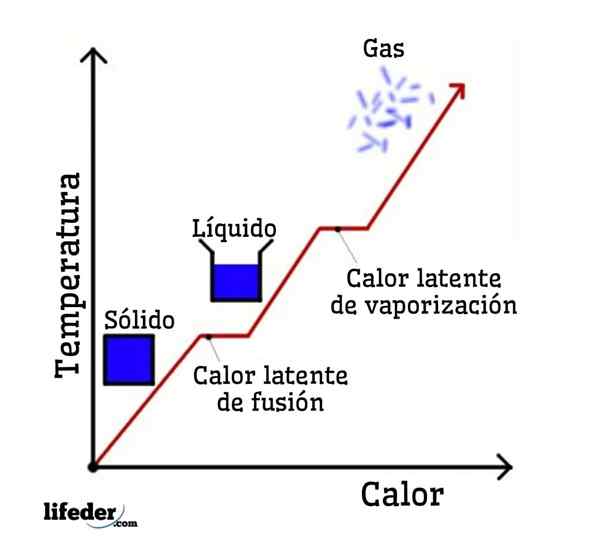
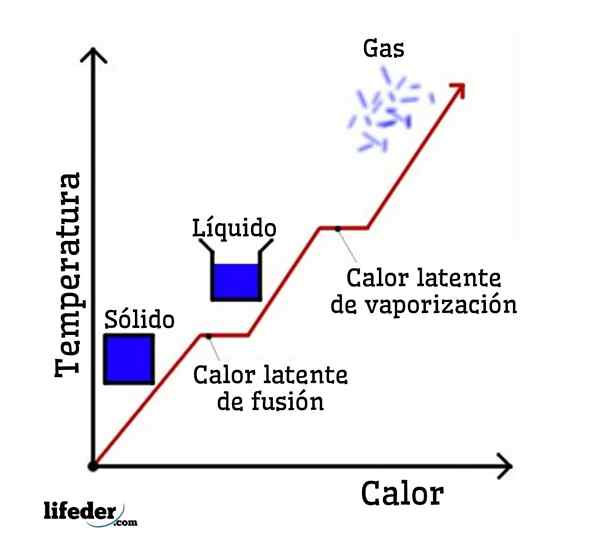
Si l'eau est prise comme exemple, les changements de phase sont les suivants: la glace (solide) fond à l'eau liquide (liquide) dans un processus appelé fusion; et l'eau liquide se vaporise à son tour pour se transformer en vapeur d'eau (gaz) en un processus appelé vaporisation.
D'un autre côté, la vapeur d'eau est refroidie dans l'eau liquide dans un processus appelé condensation; et l'eau liquide redevient de la glace dans un processus appelé solidification.
Chacun de ces changements de phase a une chaleur latente associée, qui peut être positive (absorption) ou négative (libération).
Chaleur de fusion latente
 Passer du solide au liquide; la fusion
Passer du solide au liquide; la fusion C'est la quantité de chaleur qui doit être fournie à une certaine quantité de substance solide pour changer sa condition physique du solide à liquide. Pendant la fusion, il n'y a pas de changement de température, donc tandis que le solide est fondé ou fondu le liquide généré à partir de celui-ci a la même température que le solide entier.
Généralement, cette chaleur est déterminée dans le point de fusion normal, qui est la température à laquelle le solide commence à fusionner sous pression atmosphérique. À cette température, il y a un équilibre ou une présence simultanée en même temps de l'état solide et de l'état liquide.
Peut vous servir: variable catégorique: caractéristiques et exemplesLe solide est caractérisé par la présence d'une structure compacte en raison de l'existence de liaisons chimiques à grande énergie, qui lui donnent une rigidité structurelle. Pour la transformation d'un solide en liquide, ces interactions doivent être brisées, il est donc consommé (absorber) l'énergie à cette fin.
Un exemple typique est lorsqu'une glace est consommée, formée par l'eau, le sucre et d'autres substances. Il est courant d'observer que la glace, si elle n'est pas consommée rapidement, commence à fondre, c'est-à-dire pour faire fondre. Cela se produit lorsque la température de la crème glacée atteint le point de fusion de la glace.
Exemples
Quelques exemples de chaleurs de fusion latente exprimés en J / G seront répertoriés; c'est-à-dire l'énergie qu'un gramme de solide doit absorber pour fondre au point de fusion:
-Glace 334.0
-380 Aluminium.0
-Soufre 38.1
-Cuivre 134.0
-Ethanol 104.0
-Mercure 11.8
-Or 64.5
-Argent 80.3
-Avance 24.5
-Tungstène 184
La glace absorbe très la chaleur non pas parce que ses interactions sont plus fortes, mais parce qu'elle est capable de dissiper exceptionnellement une chaleur entre ses cristaux.
La chaleur latente de vaporisation
C'est la quantité de chaleur qui absorbe une certaine substance pour passer de l'état liquide à l'état gazeux au point d'ébullition normal. C'est-à-dire que c'est la chaleur que le liquide absorbe lorsqu'elle bouillonne et devient gaz sans augmentation de la température.
Dans le sein du liquide, les molécules de substance peuvent interagir avec la formation de ponts d'hydrogène et pour les forces d'attraction entre les molécules. Pour passer une substance de l'état liquide à l'état gazeux, vous devez surmonter ces forces, vous devez donc fournir de la chaleur.
La chaleur sensible devient celle qui absorbe le liquide uniquement pour augmenter sa température, qui dépendra de sa chaleur spécifique. Pendant ce temps, la chaleur latente de vaporisation est utilisée pour la transformer directement en vapeur, un processus beaucoup plus facile au point d'ébullition.
Il peut vous servir: Courbe d'étalonnage: à quoi sert-il, comment le faire, des exemplesExemples
Vous trouverez ci-dessous des exemples de certains liquides avec leurs chaleurs latentes respectives de vaporisation exprimées à nouveau en j / g:
-Acide acétique 402
-Acétone 518
-Eau 2256
-Alcool éthylique 846
-Soufre 1510
-Benzène 390
-Dioxyde de carbone 574
-Chlore 293
-Ether 377
-Glycérine 974
-Mercure 295
-Oxygène 214
Remarquez l'énorme chaleur latente de l'eau liquide: 1 g d'eau liquide (environ 1 ml) doit absorber 2256 J pour vaporiser. L'eau liquide dissipe toujours la chaleur qu'elle reçoit beaucoup mieux par rapport à la glace.
Chaleur de solidification latente
C'est la chaleur qui doit détacher une certaine quantité de substance pour se déplacer de son état liquide à son état solide au point de solidification ou de congélation. Encore une fois, jusqu'à ce que le liquide ne se soit pas complètement solidifié, la température restera constante.
Le processus de solidification est inverse au processus de fusion, de sorte que les valeurs de la chaleur latente de la solidification et celles de la chaleur latente de la fusion sont égales, mais des signes opposés.
Les molécules d'une substance dans l'état liquide se déplacent avec une certaine liberté en raison de l'énergie qu'ils ont. Par conséquent, pour passer à la phase solide, les molécules doivent libérer de l'énergie sous forme de chaleur, ce qui permet une plus grande interaction entre les molécules de substance.
L'interaction entre les molécules favorise la formation des liaisons chimiques de la phase solide. Un exemple de cela se produit lorsque de l'eau liquide est placée dans les récipients pour la formation de glace dans le réfrigérateur du réfrigérateur. Le congélateur extrait la chaleur de l'eau liquide et est solidifié pour devenir de la glace.
Exemples
Vous trouverez ci-dessous quelques exemples de chaleurs de solidification latente (en j / g) pour certains liquides:
Peut vous servir: trou blanc: histoire, théorie et comment elle se forme-Eau (-334)
-Aluminium (-380)
-Soufre (-38)
-Cuivre (-134)
-Éthanol (-104)
Chaleur de condensation latente
C'est la quantité de chaleur qui doit être libérée ou libérée d'une certaine quantité de substance, pour passer de l'état de gaz à l'état liquide. Le gaz condensé et le liquide formé maintient la même température pendant la condensation.
La condensation est un processus contraire à la vaporisation. La chaleur de condensation latente a la même valeur que la chaleur latente de vaporisation, mais avec le signe opposé, et au point d'ébullition. Un exemple de cela est quand il est cuit et que la vapeur est condensée dans la face intérieure des pots.
Les molécules gazeuses se déplacent librement conduite par l'énergie qu'ils ont. Par conséquent, ils doivent libérer de l'énergie pour permettre la création des interactions intermoléculaires de l'état liquide entre les molécules de la substance.
Dans la nature, il existe de nombreux autres exemples du phénomène de condensation de l'eau. La vapeur d'eau monte dans l'atmosphère et se condense dans les nuages sous forme de gouttes d'eau.
Il y a aussi la présence de gouttelettes d'eau dans le verre des voitures, le produit de la condensation en eau due à une diminution de la température tôt le matin, constituant le Rocío si appelé So.
Exemples
Enfin, leurs chaleurs de condensation latente respectives exprimées à nouveau, en J / G: seront répertoriées pour certaines vapeurs:
-Acide acétique (-402)
-Acétone (-518)
-Eau (-2256)
-Alcool éthylique (-846)
-Soufre (-1510)
-Benzène (-390)
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Walter J. Moore. (1963). Chimie physique. Dans la cinétique chimique. Quatrième édition, Longmans.
- Wikipédia. (2020). Chaleur latente. Récupéré de: dans.Wikipédia.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Chaleur latente. Récupéré de: Britannica.com
- Boîte à outils d'ingénierie. (2003). Fluides: chaleur latente de l'évaporation. Récupéré de: EngineeringToolbox.com
- Apprentissage de la lumière. (s.F.). Changement de phase et chaleur à arrêt. Récupéré de: cours.Lumenarning.com

